- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Окислительно-восстановительные реакции
Содержание
- 2. Основа жизнедеятельности организмов (дыхание, гниение, брожение, обмен веществ, фотосинтез, горение), коррозия металлов
- 3. Основа металлургических процессов, получения серной, азотной кислот, аммиака, круговорота элементов в природе
- 4. Основа безотходных производств и мероприятий по охране окружающей среды
- 5. Причина превращения химической энергии в электрическую (работа аккумуляторов, батареек, гальванических элементов)
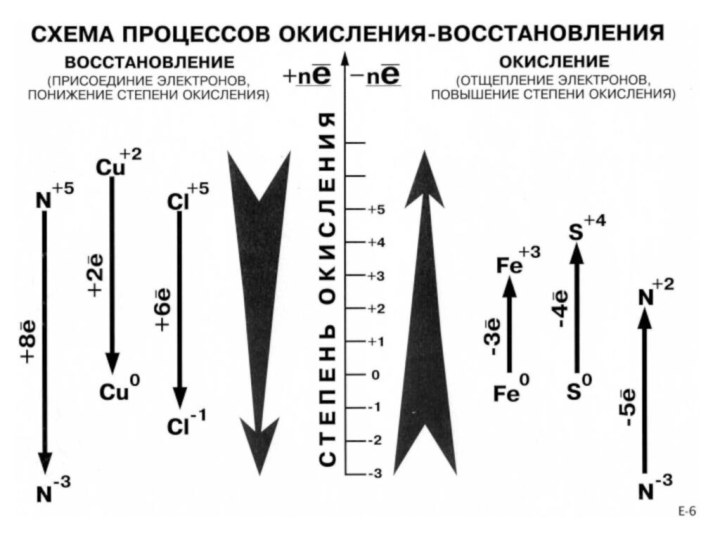
- 6. Окислительно-восстановительные реакции химические реакции, в результате которых
- 7. Степень окисления - это условный
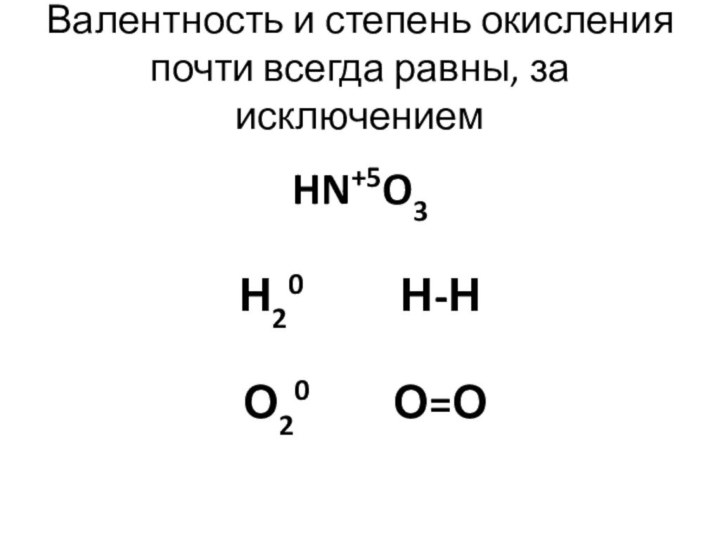
- 8. Валентность и степень окисления почти всегда равны,
- 9. Возможные степени окисления элементова) металлы подгруппы А
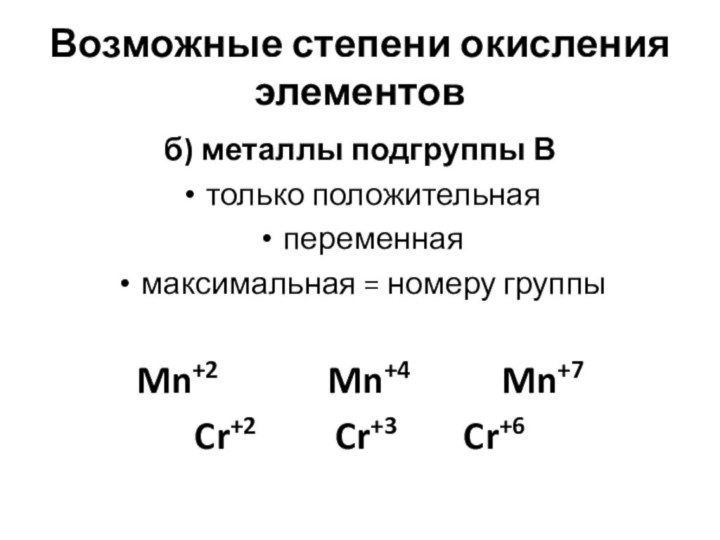
- 10. Возможные степени окисления элементовб) металлы подгруппы Втолько
- 11. Возможные степени окисления элементовв) неметаллыи положительная и
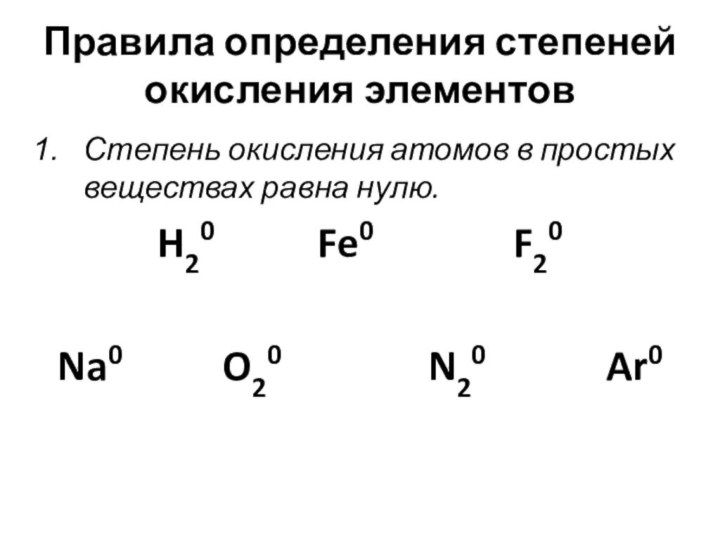
- 12. Правила определения степеней окисления элементов
- 13. Правила определения степеней окисления элементов 2.
- 14. Правила определения степеней окисления элементов 3.
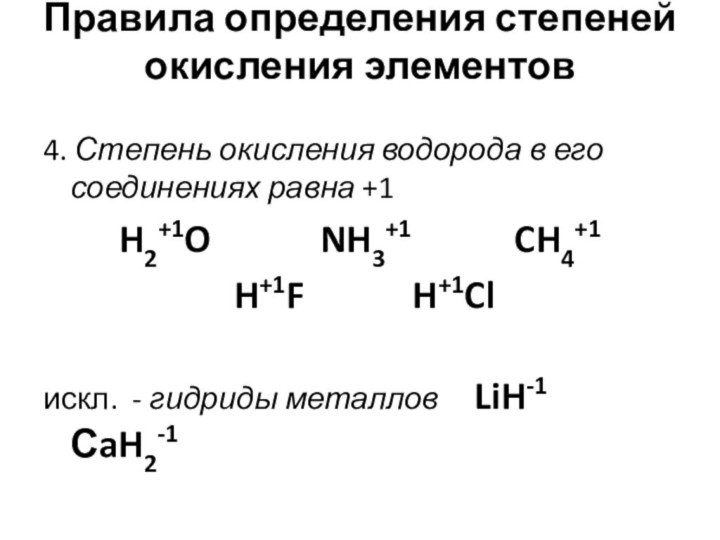
- 15. Правила определения степеней окисления элементов 4.
- 16. Правила определения степеней окисления элементов 5.
- 17. Правила определения степеней окисления элементов 6.
- 18. Окислитель - это атомы, ионы или молекулы,
- 20. Окислительно-восстановительные возможности элементов Соединения, в состав
- 21. Важнейшие окислителиГалогены, восстанавливаясь, приобретают степень окисления –1,
- 22. Важнейшие окислители2. Кислород O2, восстанавливаясь, приобретает степень окисления –24Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
- 23. Важнейшие окислители3. Азотная кислота HNO3 за счет
- 24. Важнейшие окислители4. Соли азотной кислоты (нитраты) могут
- 25. Важнейшие окислители5. Царская водка – смесь концентрированных
- 26. Важнейшие окислители6. Серная кислота H2SO4 проявляет окислительные
- 27. Важнейшие окислители7. Кислородсодержащие кислоты галогенов и их
- 28. Важнейшие окислители8. Перманганат калия KMnO4 проявляет окислительные
- 29. Важнейшие окислители9. Дихромат калия K2Cr2O7, в состав
- 30. Важнейшие окислители10. Ион водорода Н+ выступает как
- 31. Важнейшие окислители11. Ионы металлов в относительно высокой
- 32. Окислительно-восстановительные возможности элементов
- 33. Важнейшие восстановители Активные металлы (щелочные и щелочно-земельные
- 34. Важнейшие восстановители 2. Некоторые неметаллы (H2, C,
- 35. Важнейшие восстановители 3. Бескислородные анионы (Cl−, Br−,
- 36. Важнейшие восстановители 4. Катионы металлов в низшей
- 37. Окислительно-восстановительные возможности элементов Вещества, содержащие элементы
- 38. Окислительно-восстановительная двойственностьГалогены под действием более сильных окислителей
- 39. Окислительно-восстановительная двойственность2. Кислородсодержащие кислоты галогенов и их
- 40. Окислительно-восстановительная двойственность3. Перекись водорода в присутствии типичных
- 41. Окислительно-восстановительная двойственность4. Азотистая кислота и нитриты могут
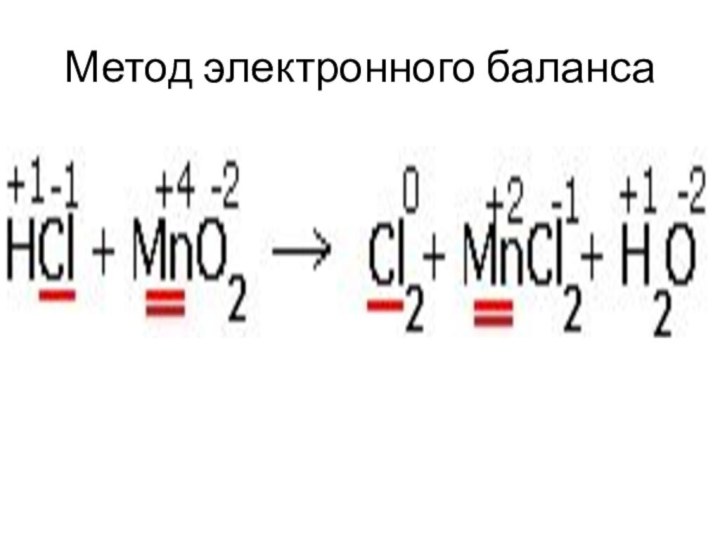
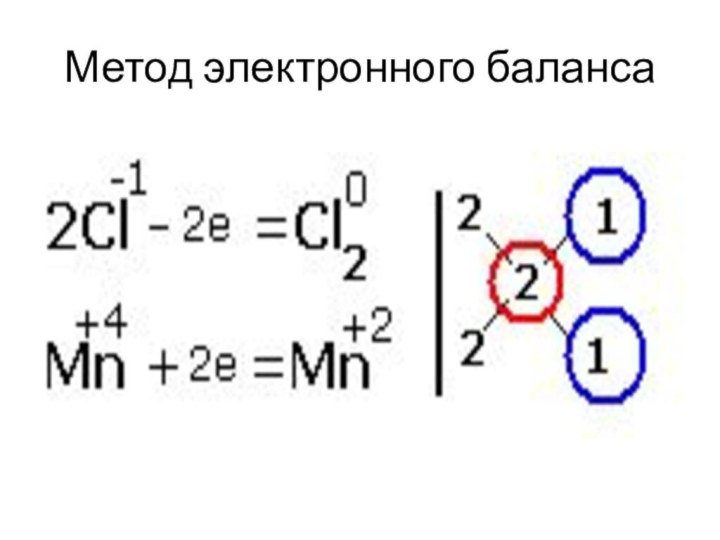
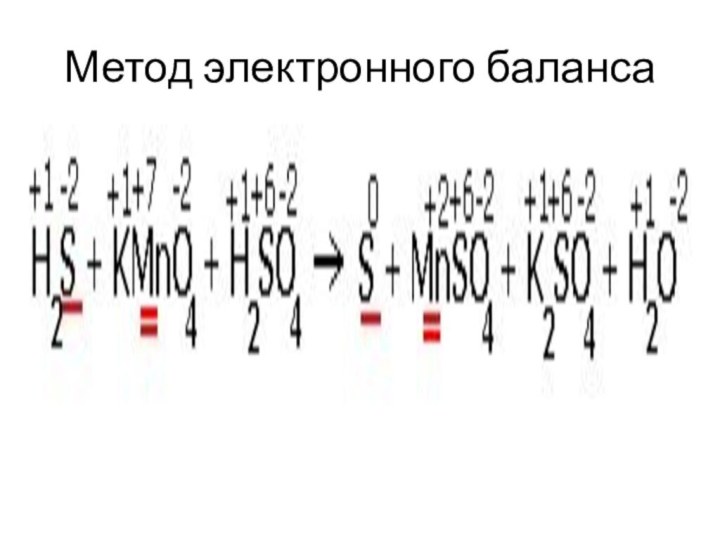
- 42. Метод электронного балансаОпределить степени окисления всех элементов.Выписать
- 43. Метод электронного баланса4. Определить переход электронов, наименьшее общее кратное, коэффициенты.5. Уравнять.6. Определить окислитель и восстановитель.
- 44. Метод электронного баланса
- 45. Метод электронного баланса
- 46. Метод электронного баланса
- 47. Метод электронного баланса
- 48. Метод электронного баланса
- 49. Метод электронного баланса
- 50. Метод электронного баланса
- 51. Метод электронного баланса
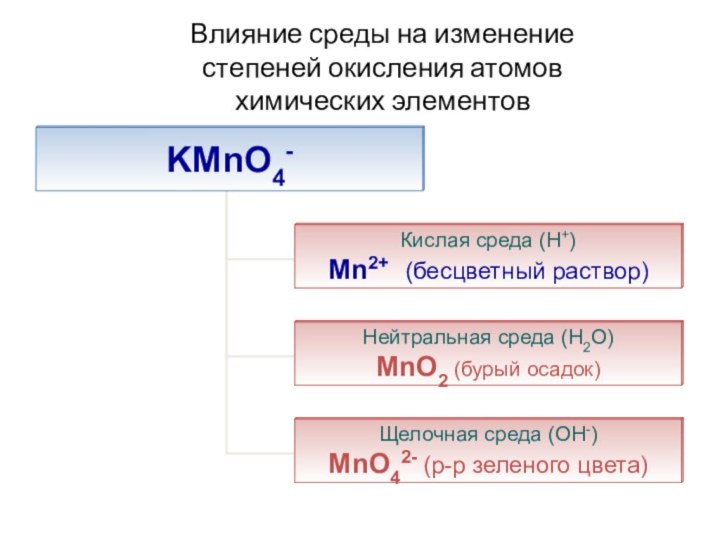
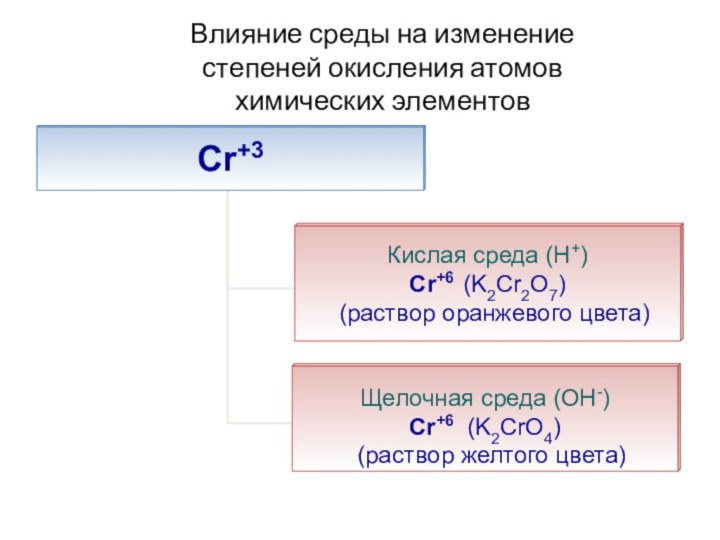
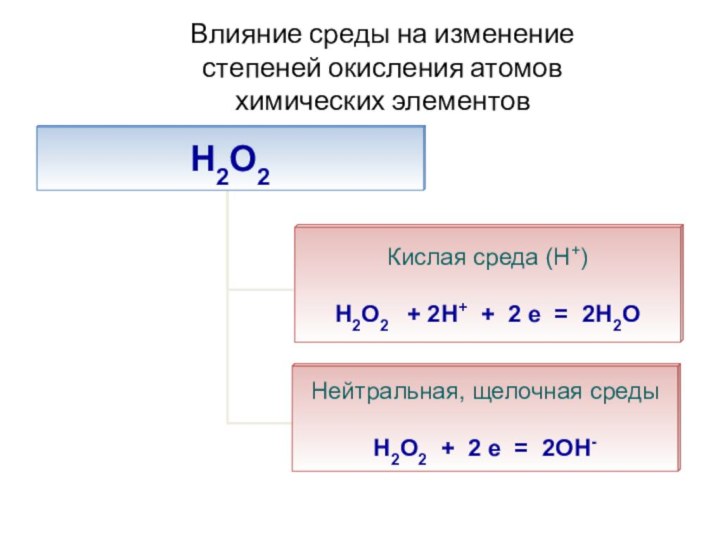
- 52. Влияние среды на изменение степеней окисления атомов химических элементов
- 53. Реакция в кислой среде
- 54. Реакция в нейтральной среде
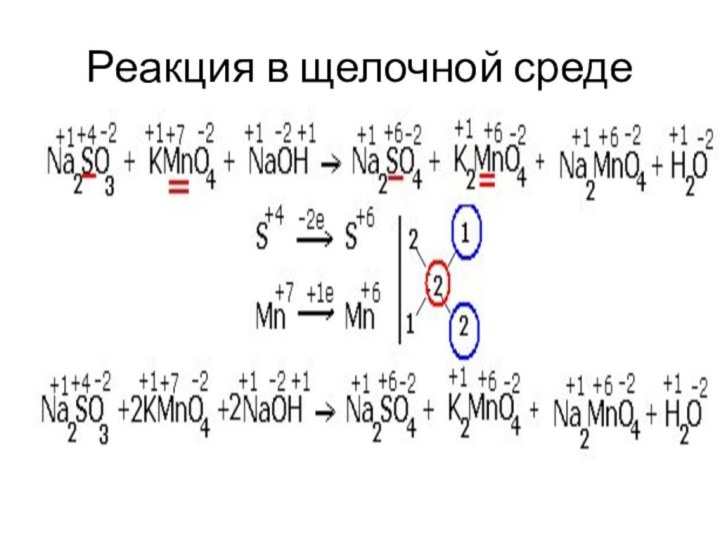
- 55. Реакция в щелочной среде
- 56. Влияние среды на изменение степеней окисления атомов химических элементов
- 57. Влияние среды на изменение степеней окисления атомов химических элементов
- 58. Влияние среды на изменение степеней окисления атомов химических элементов
- 59. Классификация ОВР1. Если окислитель и восстановитель –
- 60. Классификация ОВР3. Реакции диспропорционирования могут происходить, если
- 61. Классификация ОВР4. Реакции контрпропорционирования – это процессы
- 62. Классификация ОВР 5. Существуют реакции смешанного
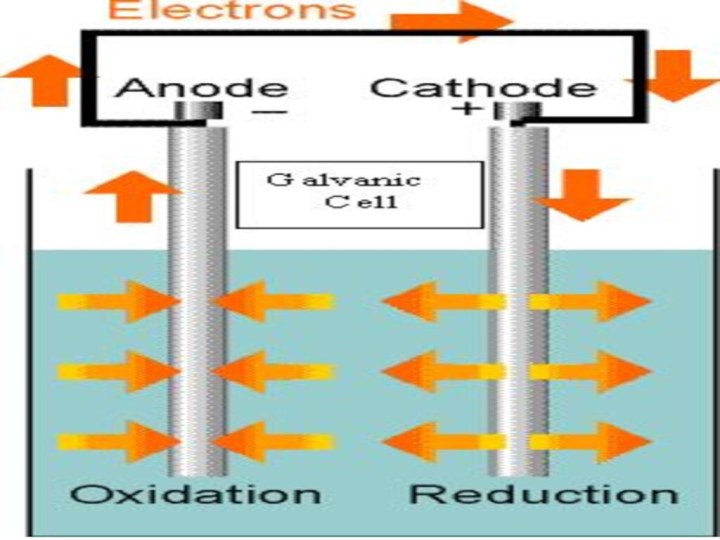
- 63. Электролиз Совокупность окислительно-восстановительных реакций,
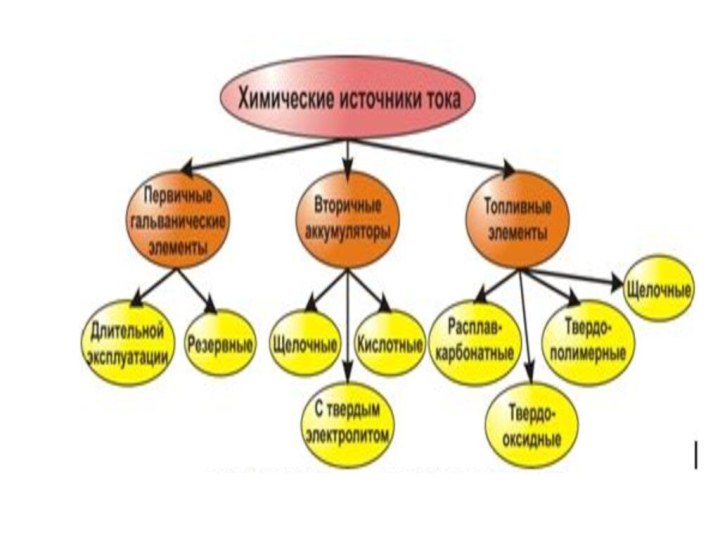
- 64. Химические источники тока Устройства для прямого преобразования химической энергии окислительно-восстановительной реакции в электрическую энергию.
- 66. Устройство гальванического элемента Гальванический элемент- химический
- 67. Источники электрического тока
- 68. Источники тока прошлого века
- 69. Из нескольких гальванических элементов можно составить батарею
- 70. Батарея (элемент питания) - обиходное название источника
- 71. Химический источник тока многоразового действияАккумулятор Электрические аккумуляторы используются для накопления энергии и автономного питания различных потребителей
- 73. Герметичные малогабаритные аккумуляторы (ГМА) Используются в
- 74. Скачать презентацию
- 75. Похожие презентации
Основа жизнедеятельности организмов (дыхание, гниение, брожение, обмен веществ, фотосинтез, горение), коррозия металлов

























































Слайд 2 Основа жизнедеятельности организмов (дыхание, гниение, брожение, обмен веществ,
фотосинтез, горение),
Слайд 3
Основа металлургических процессов,
получения серной, азотной кислот, аммиака,
круговорота элементов в природе
Слайд 5 Причина превращения химической энергии в электрическую (работа аккумуляторов,
батареек, гальванических элементов)
Слайд 6
Окислительно-восстановительные реакции
химические реакции, в результате которых происходит
изменение степеней окисления атомов химических элементов или ионов, образующих
реагирующие вещества
Слайд 7
Степень окисления
- это условный заряд,
который приобретает атом при присоединении или отдаче электронов
ее определяют, условно считая, все полярные связи полностью ионными
Слайд 9
Возможные степени окисления элементов
а) металлы подгруппы А
только
положительная
постоянная
равна номеру группы
Na +1 Са
+2
Слайд 10
Возможные степени окисления элементов
б) металлы подгруппы В
только положительная
переменная
максимальная
= номеру группы
Mn+2
Mn+4 Mn+7 Cr+2 Cr+3 Cr+6
Слайд 11
Возможные степени окисления элементов
в) неметаллы
и положительная и отрицательная
макс.
положительная = номеру группы
Cl+7
S+6мин. отрицательная = (номер группы - 8)
Cl -1 S -2
Слайд 12
Правила определения степеней окисления элементов
Степень окисления атомов
в простых веществах равна нулю.
H20
Fe0 F20 Na0 O20 N20 Ar0
Слайд 13
Правила определения степеней окисления элементов
2. Степень окисления
простого иона равна его заряду.
H+ (+1)
Fe3+ (+3) F– (-1) Сa2+ (+2)
Слайд 14
Правила определения степеней окисления элементов
3. Заряд сложного
иона равен сумме всех степеней окисления с учетом индексов.
(S+4O3-2)2-
(Р+5O4-2)3-
Слайд 15
Правила определения степеней окисления элементов
4. Степень окисления
водорода в его соединениях равна +1
H2+1O
NH3+1 CH4+1 H+1F H+1Cl
искл. - гидриды металлов LiH-1 СaH2-1
Слайд 16
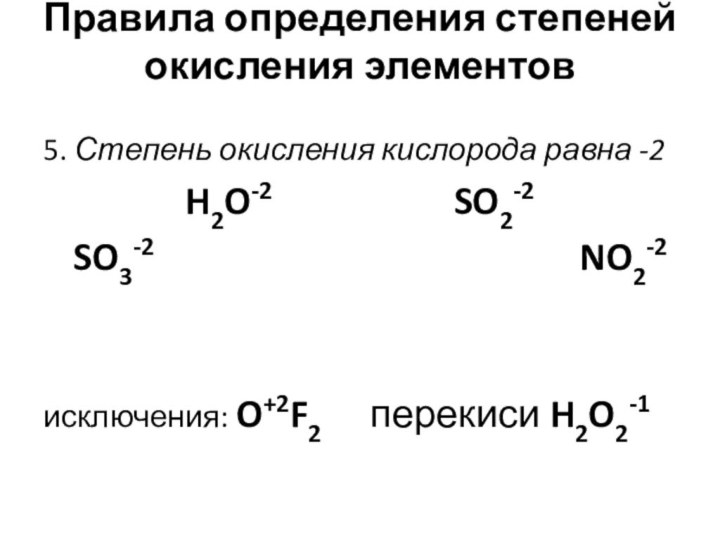
Правила определения степеней окисления элементов
5. Степень окисления
кислорода равна -2
H2O-2
SO2-2 SO3-2 NO2-2
исключения: O+2F2 перекиси H2O2-1
Слайд 17
Правила определения степеней окисления элементов
6. Сумма степеней
окисления всех атомов с учетом индексов в сложном веществе
равна нулюК2+1S+4O3-2 +1*2 + 4*1 -2*3 = 0
Са+2S+6O4-2 +2*1 + 6*1 -2*4 = 0
Слайд 18
Окислитель - это атомы, ионы или молекулы, которые
принимают электроны.
Восстановитель - это атомы, ионы или молекулы, которые
отдают электроны.
Слайд 20
Окислительно-восстановительные возможности элементов
Соединения, в состав
которых входят атомы элементов в своей максимальной (положительной) степени
окисления могут только восстанавливаться, выступая в качестве окислителей
Слайд 21
Важнейшие окислители
Галогены, восстанавливаясь, приобретают степень окисления –1, причем
от фтора к йоду их окислительные свойства ослабевают
2H2O +
2F2 = O2+ 4HF
Слайд 22
Важнейшие окислители
2. Кислород O2, восстанавливаясь, приобретает степень окисления
–2
4Fe(OH)2 + O2 + 2H2O = 4 Fe(OH)3
Слайд 23
Важнейшие окислители
3. Азотная кислота HNO3 за счет азота
в степени окисления +5:
3 Сu
+ 8 HNO3 (разб) = 3 Cu(NO3)2 + +2 NO↑ + 4 H2OПри этом возможно образование различных продуктов восстановления.
Это зависит от концентрации кислоты, а также от активности восстановителя.
Слайд 24
Важнейшие окислители
4. Соли азотной кислоты (нитраты) могут восстанавливаться
в кислотной, а при взаимодействии с активными металлами и
в щелочной средах, а также в расплавах:Zn + KNO3 + 2KOH = K2ZnO2 + KNO2 +
+ H2O
Слайд 25
Важнейшие окислители
5. Царская водка – смесь концентрированных азотной
и соляной кислот, смешанных в соотношении 1:3 по объему
Au + HNO3(конц) + 4HCl(конц) =H[AuCl4]+ + NO↑+ +2H2O
Слайд 26
Важнейшие окислители
6. Серная кислота H2SO4 проявляет окислительные свойства
в концентрированном растворе за счет серы в степени окисления
+6C(графит)+ 2H2SO4 (конц)= СO2↑ + 2SO2↑+ + 2H2O
Состав продуктов восстановления (H2S, S, SO2) определяется главным образом активностью восстановителя и концентрацией кислоты
Слайд 27
Важнейшие окислители
7. Кислородсодержащие кислоты галогенов и их соли
часто используются как окислители, хотя многие из них проявляют
двойственный характер.MnS + 4HСlO = MnSO4 + 4HCl
5Na2SO3 + 2HIO3 = 5Na2SO4 + I2 + H2O
Слайд 28
Важнейшие окислители
8. Перманганат калия KMnO4 проявляет окислительные свойства
за счет марганца в степени окисления +7
В зависимости от
среды, в которой протекает реакция, он восстанавливается до разных продуктов
Слайд 29
Важнейшие окислители
9. Дихромат калия K2Cr2O7, в состав молекулы
которого входит хром в степени окисления +6, является сильным
окислителем при спекании и в кислотном растворе:6KI + K2Cr2O7 + 7H2SO4 (разб) = 3I2 + Cr2(SO4)3 + 7H2O + 4K2SO4
и в нейтральной среде:
3H2S + K2Cr2O7 + H2O = 3S↓ + 2Cr(OH)3↓ + 2KOH
Слайд 30
Важнейшие окислители
10. Ион водорода Н+ выступает как окислитель
при взаимодействии активных металлов с разбавленными растворами кислот (за
исключением HNO3):Mg + H2SO4 (разб) = MgSO4 + H2↑
Слайд 31
Важнейшие окислители
11. Ионы металлов в относительно высокой степени
окисления (Fe+3, Cu2+, Hg+2) восстанавливаясь, превращаются в ионы более
низкой степени окисления:H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
или выделяются из растворов их солей в виде металлов:
2Al + 3CuCl2 = 2AlCl3 + 3Cu
Слайд 32
Окислительно-восстановительные возможности элементов
Соединения,
содержащие элементы в их минимальной степени окисления могут только
окисляться и выступать в качестве восстановителей
Слайд 33
Важнейшие восстановители
Активные металлы (щелочные и щелочно-земельные металлы, цинк,
алюминий, железо и др.)
Zn + 2HCl = ZnCl2
+ H2↑
Слайд 34
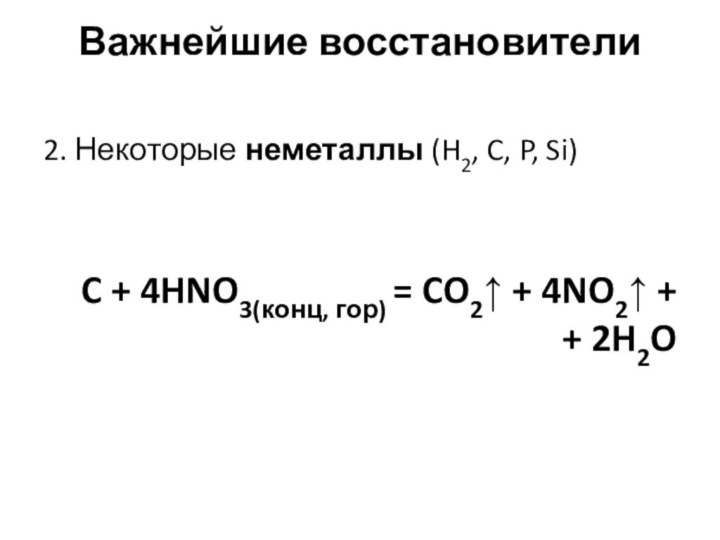
Важнейшие восстановители
2. Некоторые неметаллы (H2, C, P, Si)
C + 4HNO3(конц, гор) = CO2↑ + 4NO2↑ +
+ 2H2O
Слайд 35
Важнейшие восстановители
3. Бескислородные анионы (Cl−, Br−, I−, S2−,H−)
2HBr(конц)
+ Н2O2(конц) = Br2 + 2H2O
2CaH2 + TiO2 =
2CaO + Ti +2H2↑
Слайд 36
Важнейшие восстановители
4. Катионы металлов в низшей степени окисления
2
FeSO4 + H2O2(конц) + H2SO4(разб) =
= Fe2(SO4)3 + 2H2O
Слайд 37
Окислительно-восстановительные возможности элементов
Вещества, содержащие элементы в
промежуточных степенях окисления обладают окислительно-восстановительной двойственностью.
В зависимости от
партнера по реакции способны и принимать, и отдавать электроны
Слайд 38
Окислительно-восстановительная двойственность
Галогены под действием более сильных окислителей проявляют
восстановительные свойства (за искл. F2 ).
Их окислительные способности уменьшаются, а восстановительные способности увеличиваются от Cl2 к I2I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
Слайд 39
Окислительно-восстановительная двойственность
2. Кислородсодержащие кислоты галогенов и их соли,
в состав молекул которых входит галоген в промежуточной степени
окисления (+1, +3, +5)окислитель: S0 + NaCl+3O2 = NaCl-1 + S+4O2↑
восстановитель:
5 NaCl+3O2 + 2 KMn+7O4 + 3 H2SO4 (разб ) = = 5 NaCl+5O3 + 2 Mn+2SO4 + 3 H2O + K2SO4
Слайд 40
Окислительно-восстановительная двойственность
3. Перекись водорода в присутствии типичных восстановителей
проявляет окислительные свойства
2KI-1 + H2O2-1 = I20 + 2KO-2H
при взаимодействии с сильными окислителями проявляет восстановительные свойстваH2O2-1 +2Hg+2(NO3)2 = O20↑ + Hg+12(NO3)2 + + 2HNO3
Слайд 41
Окислительно-восстановительная двойственность
4. Азотистая кислота и нитриты могут выступать
как в роли окислителей:
2I-1
+ 2HN+3O2 = I20 + 2N+2O↑ + 2H2Oтак и в роли восстановителей
2NaN+3O2(разб, гор) + O20 = 2NaN+5O30
Слайд 42
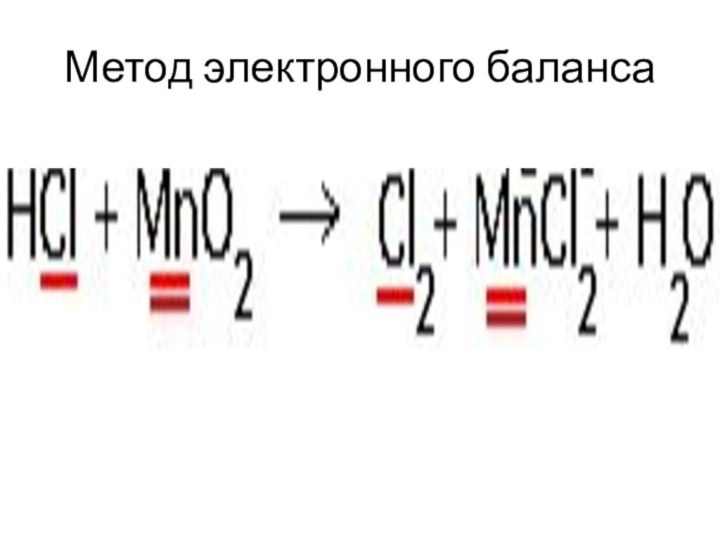
Метод электронного баланса
Определить степени окисления всех элементов.
Выписать элементы,
изменившие степень окисления.
Если степень окисления равна нулю, то индекс
нужно сохранить.
Слайд 43
Метод электронного баланса
4. Определить переход электронов, наименьшее общее
кратное, коэффициенты.
5. Уравнять.
6. Определить окислитель и восстановитель.
Слайд 59
Классификация ОВР
1. Если окислитель и восстановитель – разные
вещества, то такие реакции относят к межмолекулярным: 4Al +
3O2 = 2Al2O32. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными:
( NH4)2 Cr2O7 = N2↑ + Cr2O3 + 4H2O
Слайд 60
Классификация ОВР
3. Реакции диспропорционирования могут происходить, если соединения,
содержащие элементы в промежуточных степенях окисления, попадают в условия,
где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается и понижается:2Н2О 2 = 2Н2О + О2↑
Слайд 61
Классификация ОВР
4. Реакции контрпропорционирования – это процессы взаимодействия
окислителя и восстановителя, в состав которых входит один и
тот же элемент в разных степенях окисления. В результате продуктом окисления и продуктом восстановления является вещество с промежуточной степенью окисления атомов данного элемента:Na2 SO3 + 2Na2 S + 6HCl = 3 S + 6NaCl + 3H2O
Слайд 62
Классификация ОВР
5. Существуют реакции смешанного типа
- внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония:
NH4 NO3 = N2O ↑ + 2H2O






















![Полиэтилен — [—CH2--CH2—]n ақ түсті термопластикалық полимер](/img/tmb/15/1406372/1c2270808e41b51e646d25cbcc82036f-210x.jpg)






