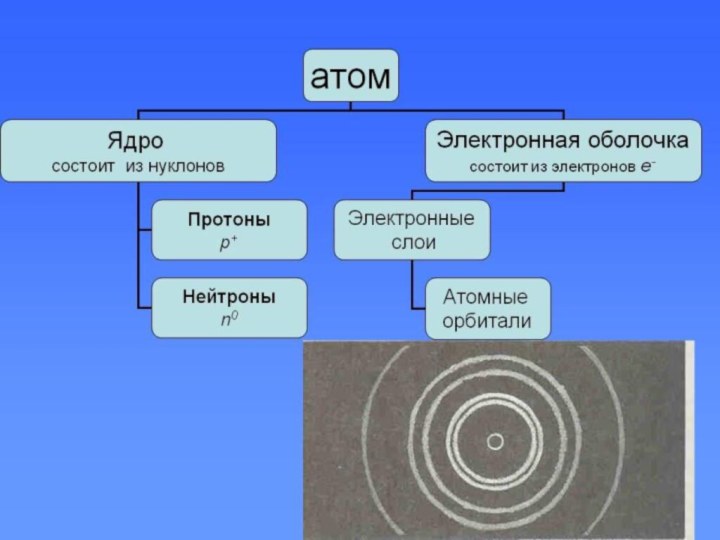
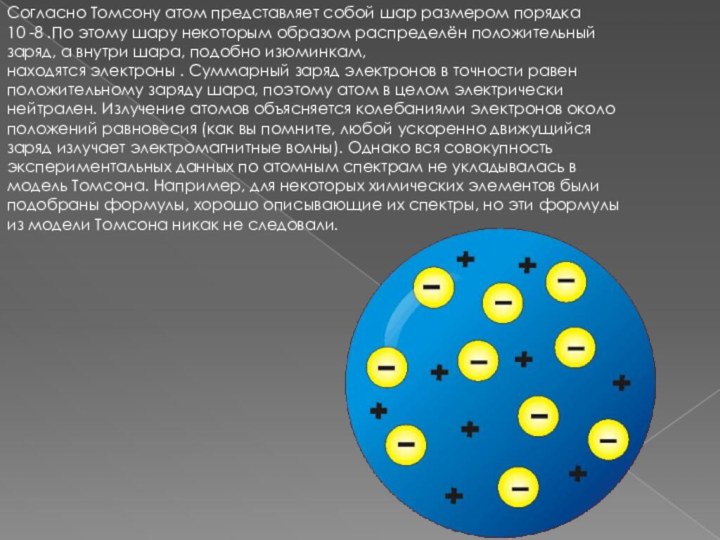
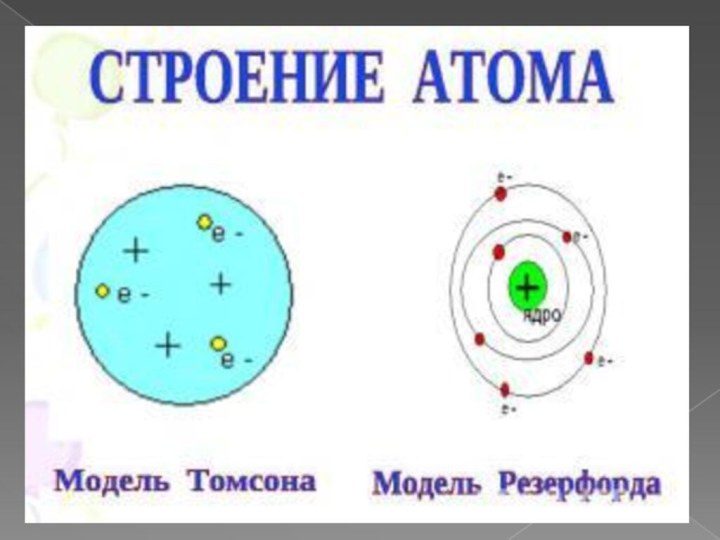
при изучении процессов прохождения электрического тока через жидкости. В
тридцатых годах XIX в. опыты выдающегося физика М. Фарадея навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.Открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью, стало прямым доказательством сложности строения атома.
В 1902 году английские учёные Эрнест Резерфорд и Фредерик Содди доказали, что при радиоактивном распаде атом урана превращается в два атома – атом тория и атом гелия. Это означало, что атомы не являются неизменными, неразрушимыми частицами.
М. Фарадей