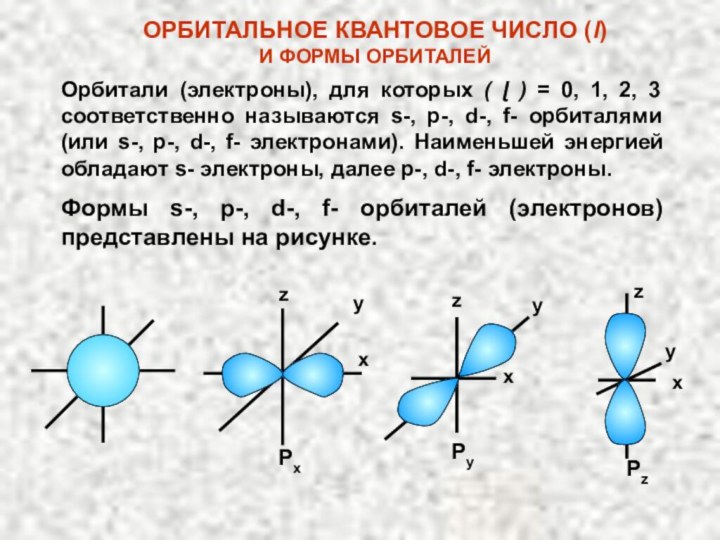
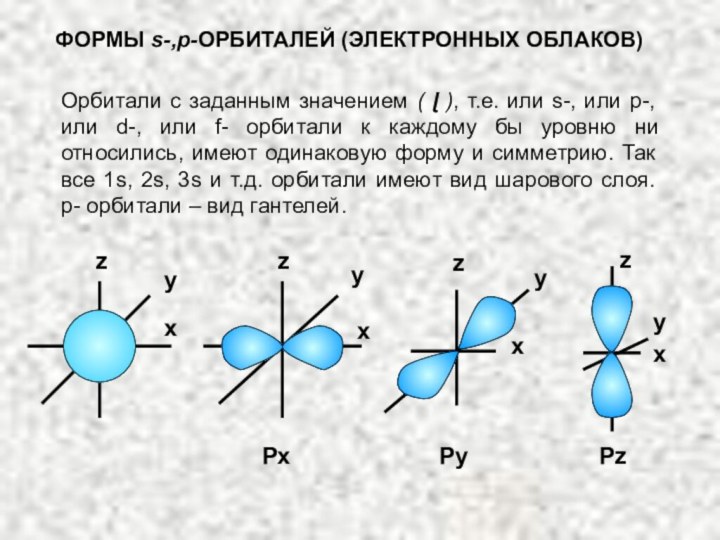
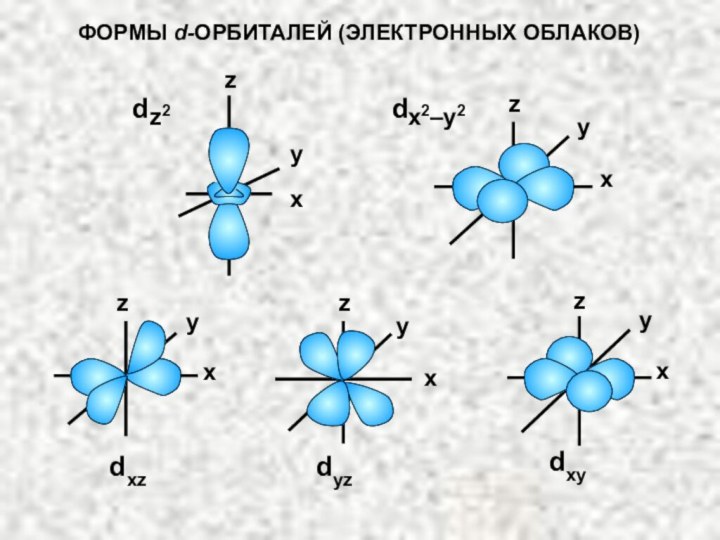
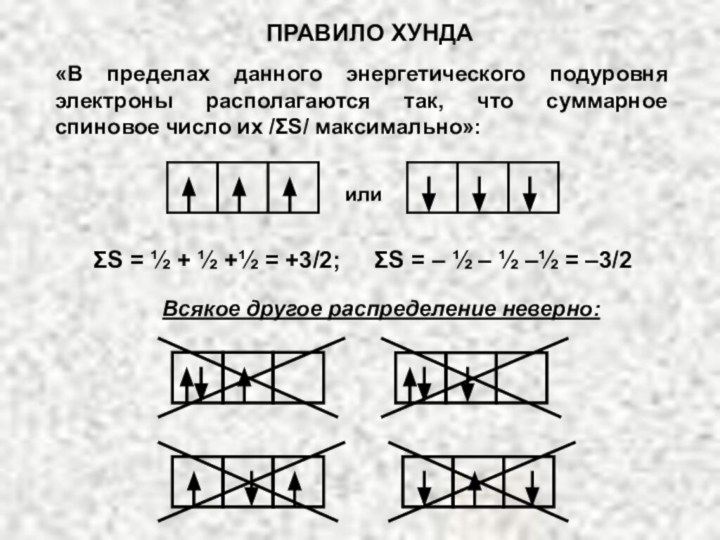
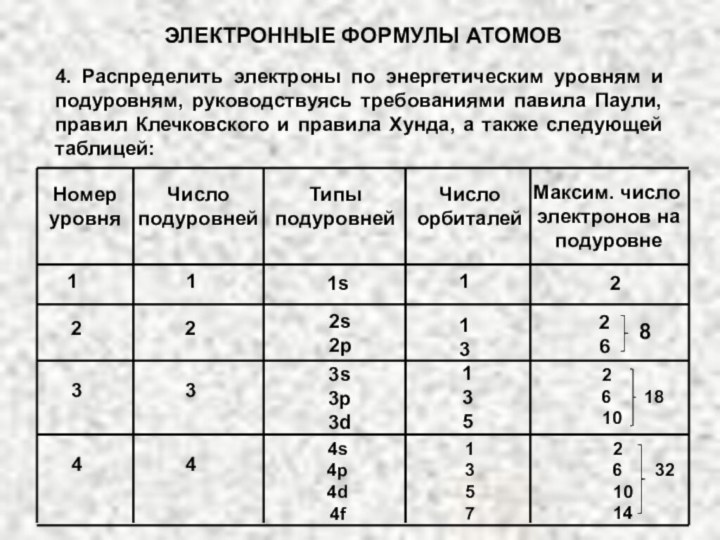
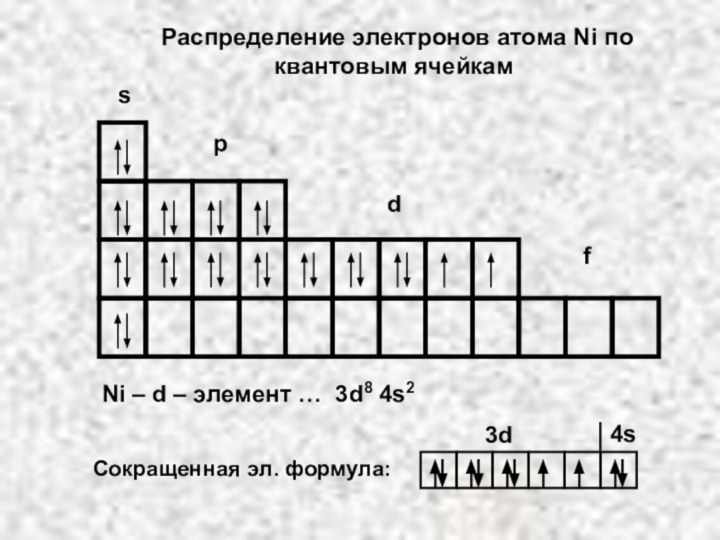
электрона в атоме. Оно может принимать значения целых чисел:
1, 2, 3 … n
Каждому значению квантового числа n соответствует свой энергетический уровень.
Число энергетических уровней в атоме заселенных электронами, равно номеру периода, в котором находится элемент в таблице Менделеева.