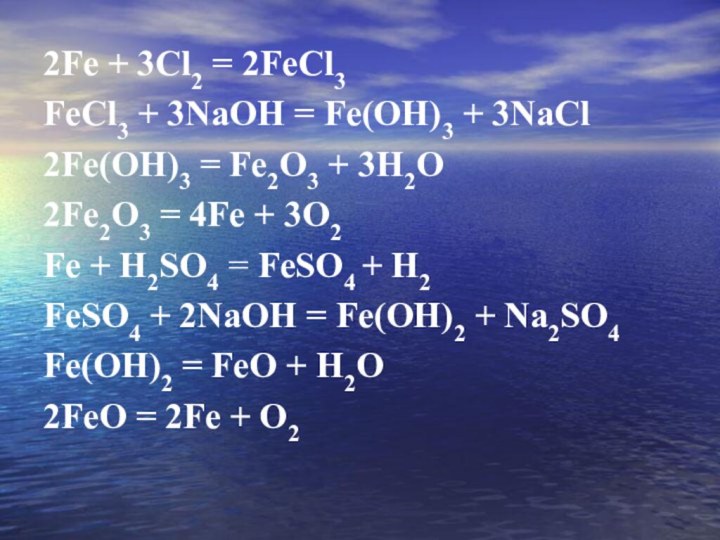Слайд 2
ОКСИДЫ – это сложные вещества, состоящие из двух
химических элементов, один из которых кислород, со степенью окисления
-2
Общая формула оксидов ЭmОn
Составьте формулы оксидов в тетради: оксида натрия, оксида алюминия (III), оксида фосфора (V), оксид углерода (IV)
Na2O, AI2O3, Р2O5, СO2
Классификация оксидов
Распределите формулы оксидов в соответствии с классификацией
Основной оксид – Na2O
Кислотный оксид – Р2O5, СO2
Амфотерный – AI2O3
Слайд 3
Способы получения оксидов
Окисление простых и сложных веществ кислородом:
1.Ме
+ О2 → оксид металла
2Zn +
О2 → 2ZnO
2.неМе + О2 → оксид неметалла
С+О2 = СО2
3.СН4 + 2О2 = СО2 + 2Н2О
Слайд 4
Взаимодействие металла с водой:
4.Ме + Н2О → оксид
Ме + Н2↑
Так взаимодействуют менее активные металлы в
ряду активности
до (Н2) при нагревании
Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
Zn + Н2О → ZnO + Н2↑
Слайд 5
Разложением:
5. Нерастворимых оснований
2Fe(OH)3 = Fe2O3 + 3H2O
6. Некоторых
кислот:
Н2СО3 = СО2 + Н2О
7. Некоторых солей:
СаСО3 = СаО
+ СО2
Слайд 6
Основания – сложные вещества, молекулы которых состоят из
атомов металла и одной или нескольких гидроксогрупп –ОН
Общая формула
оснований Me(ОН)y
Классификация оснований
Из предложенных вам оксидов составьте формулы их гидроксидов, классифицируйте их по растворимости и кислотности:
СaO, Na2O, Fe2O3, CuO, PbO
Сa(OH)2 – двухкислотное, малорастворимое
NaOH – однокислотное, растворимое
Fe(OH)3 – трехкислотное, нерастворимое
Cu(OH)2 – двухкислотное, нерастворимое
Pb(OH)2 – двухкислотное, нерастворимое
Слайд 7
Способы получения оснований
Щелочи получают:
1.Ме + Н2О →
щелочь + Н2↑
Обратите внимание!
Так взаимодействуют только щелочные
(IA) и щелочноземельные металлы (IIA), кроме Be и Mg
2Na + 2H2O → 2NaOH + H2↑
2.Оксид Ме + Н2О → щелочь
Обратите внимание!
Так взаимодействуют только оксиды щелочных (IA) и щелочноземельных металлов (IIA), кроме Be и Mg
Na2О + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Слайд 8
3. При реакциях обмена
соль + щелочь →
щелочь + соль
Na2SO4 + Ва(ОН)2 = BaSO4 + 2NaOH
4.Электролизом
водных растворов хлоридов калия и натрия
2NaCl + 2H2O = 2NaOH + Cl2 + H2
Слайд 9
Нерастворимые основания получают:
1. Щелочь + соль → основание
+ соль
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
Слайд 10
Кислоты - сложные вещества, состоящие из одного или
нескольких атомов водорода, способных заместиться на атом металла, и
кислотного остатка
Повторим классификацию кислот
Вспомним основные кислоты
Слайд 11
Получение кислородсодержащих кислот :
1. Оксид неМе + Н2О
→ кислота
* Исключение оксид кремния (IV) SiO2, который с
водой не реагирует
SO3 + Н2О → H2SO4
SO2 + Н2О → H2SO3
2. Кислота + соль → кислота + соль
2HCl + Na2SiO3 = H2SiO3 + 2NaCl
Слайд 12
Получение бескислородных кислот:
1. неМе + Н2 → кислота
Cl2 + H2 = 2HCl
2. соль +
кислота → кислота + соль
NaCl + H2SO4 = HCl + NaHSO4
Слайд 13
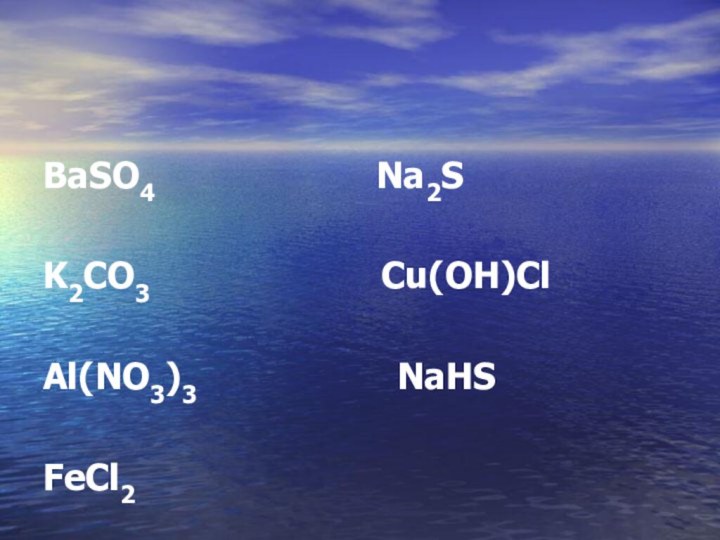
Соли - сложные вещества, состоящие из атома металла
и кислотного остатка
Вспомним классификацию солей Составим формулы солей:
сульфат бария,
карбонат калия, нитрат алюминия (III), хлорид железа (II), сульфид натрия, гидроксохлорид меди (II), гидросульфид натрия.
Na2S
K2CO3
Cu(OH)Cl
Al(NO3)3 NaHS
FeCl2
Слайд 15
Получение солей
1.Me + неМе → соль
2 Al
+ 3Cl2 → 3AlCl3
2. Ме + кислота → соль
+ Н2↑
Обратите внимание!
Для реакции не брать азотную кислоту HNO3
и конц. серную кислоту H2SO4, а также металлы, стоящие в ряду активности после Н2.
Zn + 2HCl → ZnCl2 + H2↑
3.Ме + соль → соль + Ме
Zn + CuCl2 = ZnCl2 + Cu
Слайд 16
4. Кислота + оксид Ме → соль +
Н2О
2HCl + CaO → CaCl2 + H2O
5.
Оксид Ме + оксид неМе → соль
Na2O + SO3 = Na2SO4
6. Щелочь + оксид неМе
2NaОН + СО2 = Na2СО3 + Н2О
7. Основание + кислота → соль + Н2О (реакция нейтрализации)
NaOH + HCl → NaCl + Н2О
8. Cоль + соль → соль + соль
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
Слайд 17
Закрепление:
Выберите один правильный вариант ответа
1.Образует щелочь при
взаимодействии с водой
а) СuO
б) K2O
в) Fe2O3
г) ZnO
2.При взаимодействии
натрия с водой образуется:
а) водород и оксид натрия
б) кислород и оксид натрия
в) гидроксид натрия и водород
г) гидроксид натрия и кислород
Слайд 18
3. Каким веществом надо подействовать на хлорид цинка
ZnCl2, чтобы получить гидроксид цинка Zn(OH)2:
а) H2O
б) HCl
в) Fe(OH)2
г)
КОН
4. Реакция нейтрализации протекает при взаимодействии:
а) NaCl + AgNO3
б) NaOH + HNO3
в) K2O + H2O
г) CO2 + H2O
Слайд 20
Закончите уравнения реакций, расставьте коэффициенты
а) Р +
… → Р2О5
б) S + O2 → …
в) … + O2 → CO2
г) Na + … → Na2O
а) Na + … → NaOH + …
б) CaO + … → Ca(OH)2
в) CuCl2 + … → Cu(OH)2 + …
г) … + NaOH → Al(OH)3 + NaCl
Слайд 21
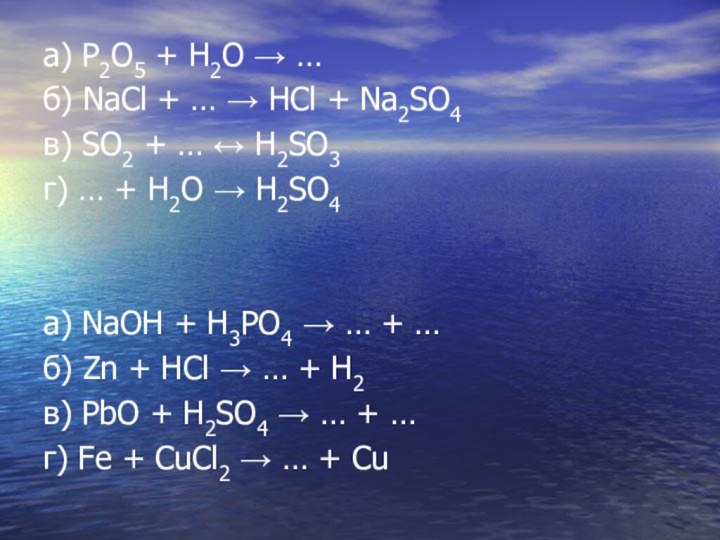
а) Р2О5 + Н2О → …
б) NaCl
+ … → HCl + Na2SO4
в) SO2 +
… ↔ H2SO3
г) … + Н2О → H2SO4
а) NaOH + H3PO4 → … + …
б) Zn + HCl → … + H2
в) PbO + H2SO4 → … + …
г) Fe + CuCl2 → … + Cu
Слайд 22
а) 4Р +5О2 → 4Р2О5
б) S +
O2 → SO2
в) С+ O2 → CO2
г)4Na +
O2 → 2Na2O
а) 2Na + 2Н2О → 2NaOH + Н2
б) CaO + Н2О → Ca(OH)2
в) CuCl2 + 2NaOH → Cu(OH)2 +2NaCl
г) AlCl3 + 3NaOH→ Al(OH3) + 3NaCl
Слайд 23
а) Р2О5+ 3Н2О → 2H3PO4
б) 2NaCl + H2SO4
→ 2HCl + Na2SO4
в) SO2 + Н2О ↔
H2SO3
г) SO3 + Н2О → H2SO4
а)3NaOH + H3PO4 → Na3PO4 + 3Н2О
б) Zn + 2HCl → ZnCl2 + H2
в) PbO + H2SO4 → PbSO4 + Н2О
г) Fe + CuCl2 → FeCl2 + Cu
Слайд 24
Составьте генетическую цепочку
MgCl2, MgO, Mg(OH),2 Mg, Mg(NO3)2.
Р2О5, Na3PO4,
Р, H3PO4, Са3(РО4)2
Слайд 25
Mg → MgO → MgCl2 → Mg(OH)2 →
Mg(NO3)2
2Mg + О2 = 2MgО
MgО + 2НCl = MgCl2
+ Н2О
MgCl2 + 2NaОН = Mg(OH)2 + 2NaCl
Mg(OH)2 + 2НNO3 = Mg(NO3)2 + 2Н2О
Р → Р2О5 → H3PO4 → Са3(РО4)2 → Na3PO4
4Р + 5О2 = 2Р2О5
Р2О5 + 3Н2О = 2H3PO4
2H3PO4 + 3СаCl2 = Са3(РО4)2 + 6НCl
Са3(РО4)2+ 6NaОН = 2Na3PO4 + 3Са(ОН)2
Слайд 26
Fe → FeCl3 → Fe(ОН)3 → Fe2О3
→ ? →
→ FeSO4 → Fe(ОН)2→ ? →
Fe
Si → ? → Na2SiО3 → Н2SiО3 → SiО2 →
→ ? → Mg2Si → SiН4 → SiО2
Слайд 27
2Fe + 3Cl2 = 2FeCl3
FeCl3 + 3NaОН
= Fe(ОН)3 + 3NaCl
2Fe(ОН)3 = Fe2О3 + 3Н2О
2Fe2О3 =
4Fe + 3О2
Fe + H2SO4 = FeSO4 + Н2
FeSO4 + 2NaОН = Fe(ОН)2 + Na2SO4
Fe(ОН)2 = FeО + Н2О
2FeО = 2Fe + О2
Слайд 28
Si + О2 = SiО2
SiО2+ Na2О = Na2SiО3
Na2SiО3 + Н2SО4 = Н2SiО3 + Na2SO4
Н2SiО3 = SiО2+
Н2О
SiО2 = Si + О2
Si + 2Mg = Mg2Si
Mg2Si + 2Н2SО4 = SiН4 + MgSO4
SiН4 + 2О2 = SiО2 + 2Н2О