- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Сера
Содержание
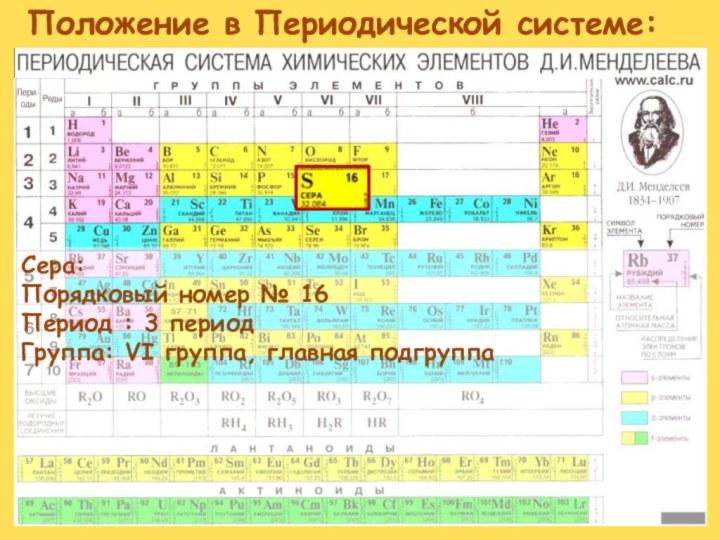
- 2. Положение в Периодической системе:Сера:Порядковый номер № 16Период : 3 периодГруппа: VI группа, главная подгруппа
- 3. S+16322681s22s2
- 4. Нахождение серы в природеСера является на 16-м
- 5. Нахождение серы в природе.Сера самородная (S)Цинковая обманка(сфалерит
- 6. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 7. Пирит – «огненный камень» (соединение серы в природе)
- 8. Сера самородная
- 9. Сера самородная
- 10. Сера самородная
- 11. Сера самородная
- 12. Сера самородная
- 13. Сера входит в состав белков. Особенно много
- 14. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 15. Физические свойства.— твердое агрегатное
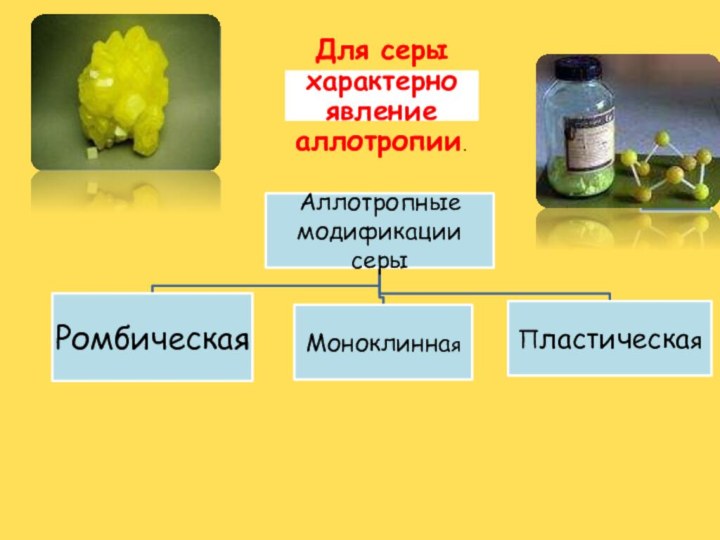
- 17. Аллотропия серы.кристаллическаяпластическая
- 18. Ромбическая сераРомбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
- 19. Моноклинная сераМоноклинная (β –сера)- S8, темно-желтые иглы,t°пл.
- 20. Пластическая сераПластическая сера- коричневая резиноподобная (аморфная) масса.Она
- 21. Химические свойства серы (восстановительные)Сера проявляет в реакциях
- 22. Химические свойства серы (окислительные)S0 + 2ē
- 23. Историческая справка.Cера встречается в природе в свободном
- 24. Историческая справкаСчиталось, что горящая сера отгоняет нечистую
- 25. Историческая справкаВ 11 в. алхимики полагали, что
- 26. Химические свойства.
- 27. Химические свойства.
- 28. Химические свойства.
- 29. Химические свойства.
- 30. Химические свойства.
- 31. Химические свойства.
- 32. Химические свойства.
- 33. Химические свойства.
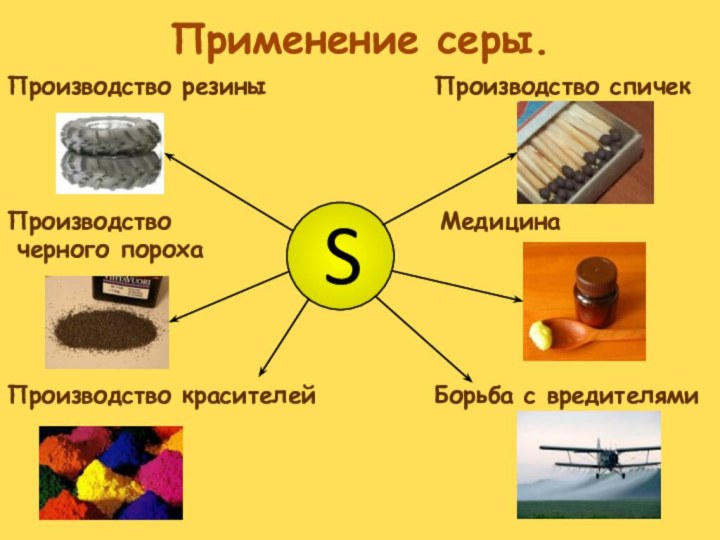
- 34. Скачать презентацию
- 35. Похожие презентации




























Слайд 3
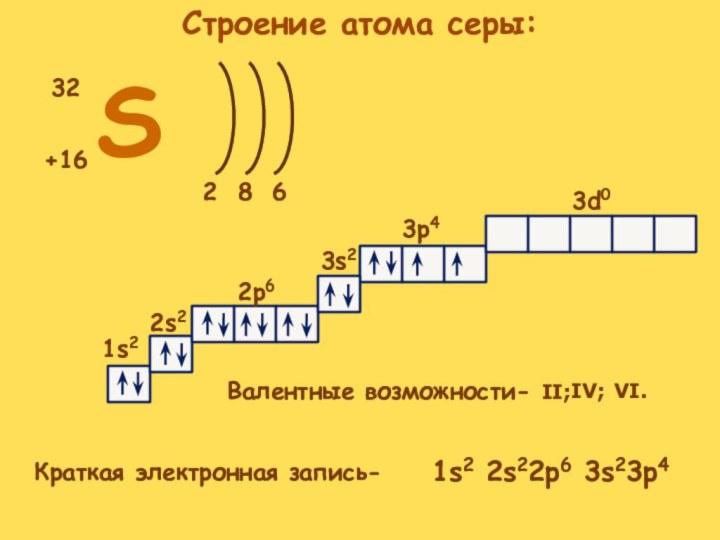
S
+16
32
2
6
8
1s2
2s2
2p6
3s2
3p4
3d0
Краткая электронная
запись-Валентные возможности- II;
IV;
VI.
Строение атома серы:
1s2 2s22p6 3s23p4
Слайд 4
Нахождение серы в природе
Сера является на 16-м месте
по распространённости в земной коре. Встречается в свободном (самородном) состоянии
и связанном виде.
Слайд 5
Нахождение серы в природе.
Сера самородная (S)
Цинковая обманка
(сфалерит ZnS)
Киноварь
(HgS)
Свинцовый блеск
(галенит PbS)
Серный колчедан
(пирит FеS2)Слайд 13 Сера входит в состав белков. Особенно много серы
в белках волос, рогов, шерсти. Кроме этого сера является
составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.Сера в природе
Слайд 15
Физические свойства.
— твердое агрегатное
состояние
— желтого
цвета— не растворима в воде
— не смачивается водой
(ФЛОТация)
— растворяется в
органических
растворителях
Слайд 18
Ромбическая сера
Ромбическая
(α-сера) – S8, желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация
Слайд 19
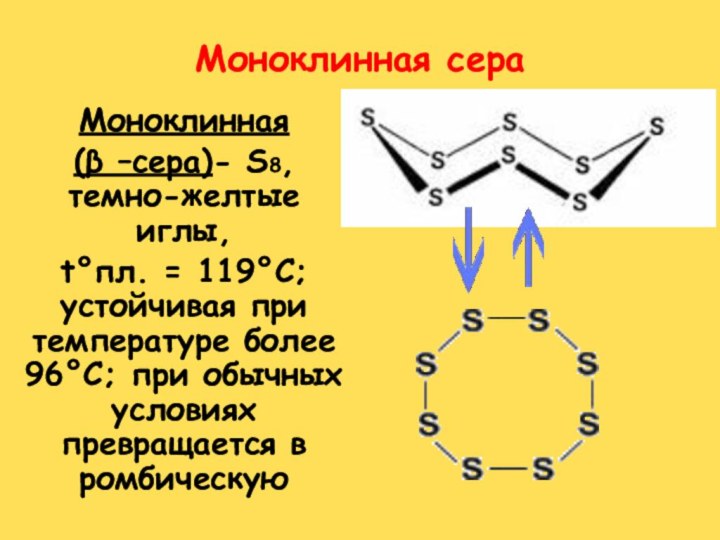
Моноклинная сера
Моноклинная
(β –сера)- S8, темно-желтые иглы,
t°пл. =
119°C; устойчивая при температуре более 96°С; при обычных условиях
превращается в ромбическую
Слайд 20
Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива
и через некоторое время становится хрупкой, приобретёт желтый цвет,
т.епревращается в ромбическую серу
Слайд 21
Химические свойства серы (восстановительные)
Сера проявляет в реакциях с
сильными окислителями:
S - 2ē S+2; S -
4ē S+4; S - 6ē S+61) C кислородом:
S + O2 t S+4O2
2S + 3O2 t;Рt 2S+6O3
2) С галогенами (кроме йода)
S + Cl2 S+2Cl2
3) С кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
Слайд 22
Химические свойства серы (окислительные)
S0 + 2ē S-2
4)
Сера реагирует со щелочными металлами без нагревания:
2Na + S
Na2Sc остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S –t Al2S3
Cu + S –t CuS
5) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
Слайд 23
Историческая справка.
Cера встречается в природе в свободном (самородном)
состоянии,
поэтому она была известна человеку уже в глубокой
древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа).
Слайд 24
Историческая справка
Считалось, что горящая сера отгоняет нечистую силу.
В Библии говорится об использовании серы для очищения грешников.
В Древнем Риме с помощью сернистого газа отбеливали ткани.
Издавна использовалась сера в медицине — ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний.
Применение горящей серы для дезинфекции упоминается Гомером.
Слайд 25
Историческая справка
В 11 в.
алхимики
полагали, что
металлы,
в том
числе золото и серебро, состоят из находящихся
в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные.
В 16 в. Парацельс считал серу наряду с ртутью и «солью» одним из основных «начал» природы, «душою» всех тел.





























