- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Реакции ионного обмена (9 класс)
Содержание
- 2. 1 тур. Разминка.Вопрос № 1.К электролитам относится1)
- 3. 4) РАСТВОР ХЛОРОВОДОРОДАОтвет.
- 4. Вопрос № 2К неэлектролитам относится1) хлорид бария
- 5. 4) оксид железа (II)Ответ.
- 6. Вопрос № 3Несколько ступеней диссоциации возможны для1)
- 7. 1) гидроксид барияВа(ОН)2 BaOH+ + OH-BaOH+ Ba2+ + OH-Ответ.
- 8. Вопрос № 4Правая часть уравнения диссоциации нитрата
- 9. 3) = Ca2+ + 2NO3-Ca(NO3)2 Ca2+
- 10. Вопрос № 5В водном растворе одновременно не
- 11. 2) Ba2+ и SO2-4Так как
- 12. 2 тур. Реакции ионного обмена1 вопрос. Сокращённое
- 13. 3) Cu2+ +S2- = CuS Cu(NO3)2 + Na2S = CuS + 2NaNO3 Ответ.
- 14. 2 вопрос.С выделением газа протекает реакция между
- 15. 3) карбоната калия и азотной кислоты К2СО2
- 16. 3 вопрос. Соляная кислота реагирует с каждым
- 17. 4) Mg(OH)2 и MgCO3Mg(OH)2 + 2 HCI
- 18. 4 вопрос. При сливании каких двух
- 19. 2) H2SO4 и Ba(OH)2т.к. Ba(OH)2 + H2SO4 =
- 20. 5 вопрос.Для качественного определения ионов, находящихся в
- 21. 2) раствор хлорида бария4) раствор гидроксида натрияCuSO4+2NaOH Na2SO4 + Cu(OH)2 CuSO4+ BaCI2 CuCI2 + BaSO4Ответ.
- 22. 6 вопрос.Для осуществления химической реакции, согласно схеме
- 23. Ответ. 4) гидроксид калияAI2(SO4)3 +3KOH AI(OH)3 + 3KCI
- 24. 7 вопрос.Даны левые части уравнений: А) СuO+H2;
- 25. Ответ. 3) Б, Д, В.Cu(OH)2 CuO
- 26. № 8.Школьникам на практической работе по определению
- 27. Ответ.AICI3Хлорид алюминияAICI3+3KOH AI(OH)3 + 3KCI
- 28. 3 тур. Расчетные задачи. Показать полное решение задач.
- 29. № 1. Для приготовления моченых яблок используют
- 30. Ответ Масса сахара равна 76,8 грамм
- 31. № 2.К 200 г 20%-ого раствора серной
- 32. Ответ. Массовая доля серной кислоты равна 16%.
- 33. № 3.К 200 г 10%-ого раствора гидроксида
- 34. Ответ Массовая доля NaOH – 20%
- 35. № 4В один сосуд вылили 200 г
- 36. Ответ 17,7 %
- 37. № 5. Майонез – эмульсия (взвесь) растительного
- 38. Ответ Объем воды 125 мл или 0,125 л
- 39. Скачать презентацию
- 40. Похожие презентации
1 тур. Разминка.Вопрос № 1.К электролитам относится1) углекислый газ2) оксид азота (II)3) расплав сахарозы4) раствор хлороводорода












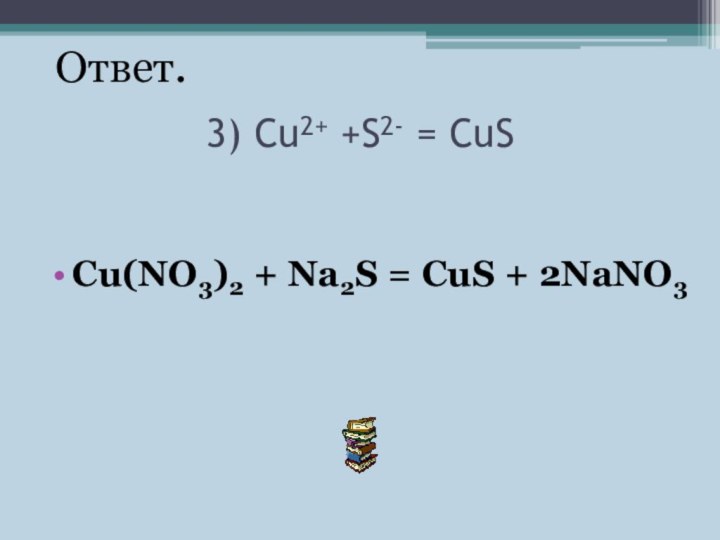

























Слайд 4
Вопрос № 2
К неэлектролитам относится
1) хлорид бария
2) серная кислота
3) нитрат железа (II)
4) оксид железа (II)
Слайд 6
Вопрос № 3
Несколько ступеней диссоциации возможны для
1) гидроксида
бария
2) гидроксида натрия
3) сульфата бария
4) воды.
Слайд 8
Вопрос № 4
Правая часть уравнения диссоциации нитрата кальция
1) =
Ca2+ + 3NO3-2) = Ca2+ + 6NO-
3) = Ca2+ + 2NO3-
4) = Ca2+ + NO3-
Напишите уравнение диссоциации
Слайд 10
Вопрос № 5
В водном растворе одновременно не могут
находиться ионы:
1) K+ и NO3-
2) Ba2+ и SO2-4 3) Na+ и SO2-4
4) Ag+ и NO3- .
Почему?
Слайд 12
2 тур. Реакции ионного обмена
1 вопрос. Сокращённое ионное
уравнение Cu2+ +S2- =CuS соответствует схеме реакции
Сu
+ S = CuSCuO + H2S = CuS + H2O
Cu(NO3)2 + Na2S = CuS + NaNO3
Cu(OH)2 + H2S = CuS + H2O.
Напишите уравнение реакции.
Слайд 14
2 вопрос.
С выделением газа протекает реакция между растворами
1)
сульфида натрия и хлорида бария
2) фосфата натрия и нитрата
серебра3) карбоната калия и азотной кислоты
4) гидроксида магния и серной кислоты.
Напишите уравнение реакции, составьте полное и сокращенное ионное уравнение.
Слайд 15
3) карбоната калия и азотной кислоты
К2СО2 + 2HNO3
2KNO3 + H2O + CO2
2K+ +CO2-3 +2H+ +
2NO3- 2K+ + 2NO3- + H2O +CO2CO2-3 +2H+ H2O +CO2
Ответ.
Слайд 16
3 вопрос.
Соляная кислота реагирует с каждым из
двух веществ:
1) Ba(NO3)2 и NaOH
2) NO2 и AgNO33) CO2 и CuO
4) Mg(OH)2 и MgCO3
Напишите уравнения реакций.
Слайд 18
4 вопрос.
При сливании каких двух растворов
в воде практически не останется ионов?
1) BaCI2 и Na2SO4
2)
H2SO4 и Ba(OH)23) HNO3 и Ba(OH)2
4) HCI и Ba(OH)2.
Почему?
Слайд 19
2) H2SO4 и Ba(OH)2
т.к. Ba(OH)2 + H2SO4 = BaSO4 +
2H2O происходит связывание всех ионов с образованием осадка и
водыОтвет.
Слайд 20
5 вопрос.
Для качественного определения ионов, находящихся в растворе
сульфата меди (II), можно использовать
1) фенолфталеин
2) раствор хлорида бария
3)
раствор нитрата калия4) раствор гидроксида натрия
5) оксид алюминия
Слайд 21
2) раствор хлорида бария
4) раствор гидроксида натрия
CuSO4+2NaOH
Na2SO4 + Cu(OH)2
CuSO4+ BaCI2 CuCI2 + BaSO4
Ответ.
Слайд 22
6 вопрос.
Для осуществления химической реакции, согласно схеме
AI2(SO4)3 AI(OH)3, необходимо использовать:
1) гидроксид цинка
2) гидроксид железа
(II) 3) гидроксид меди (II)
4) гидроксид калия
Слайд 24
7 вопрос.
Даны левые части уравнений:
А) СuO+H2; Б)
Сu(OH)2;
В) CuSO4+Fe; Г)
CuSO4+NaOH; Д) СuO + H2 SO4 .Какие из них соответствуют схеме последовательного превращения веществ: гидроксид меди(II)оксид меди(II) сульфат меди (II) медь?
Г, А, В; 2) В, А, Г; 3) Б, Д, В; 4) Б, В, Д.
Напишите схему и возможные реакции.
Слайд 25
Ответ.
3) Б, Д, В.
Cu(OH)2 CuO
CuSO4 Cu
1) Сu(OH)2 СuO + H2O
2) СuO +
H2 SO4 CuSO4 + H2O3) CuSO4+Fe Cu + FeSO4,
Слайд 26
№ 8.
Школьникам на практической работе по определению качественного
состава вещества выдали соль металла, сплавы которого широко используются
в самолётостроении и судостроении, для изготовления лёгких металлических конструкций.Учащиеся растворили кристаллы выданной соли в воде, получившийся прозрачный раствор разлили в две пробирки. В одну из них добавили несколько капель раствора гидроксида калия, при этом образовался студенистый белый осадок. В другую пробирку с раствором соли добавили несколько капель раствора нитрата серебра, при этом образовался белый «творожистый» осадок.
Запишите химическую формулу и название неизвестного вещества. Составьте два молекулярных уравнения реакций, которые были проведены в процессе его распознавания.
Слайд 27
Ответ.
AICI3
Хлорид алюминия
AICI3+3KOH AI(OH)3 + 3KCI
студенистый белый
осадок
AICI3+AgNO3 3AgCI + AI(NO3)3
белый «творожистый»
осадок.