Слайд 2
Химические реакции или химические явления – это процессы,
в результате которых из одних веществ образуются другие, отличающиеся
по составу и (или) по строению.
Условия протекания: смешение веществ, нагревание; действие света, электрического тока, излучения; механическое воздействие; изменение давления.
При химических реакциях не меняется общее число атомов каждого элемента и его изотопный состав.
HCI + NaOH = NaCI + H2O
Ядерные реакции – это превращения атомных ядер, связанное с взаимодействием их с другими ядрами или элементарными частицами.
14 7N + 4 2He → 1 1H + 17 8O
Слайд 3
I. Классификация химических реакций по числу и составу
реагирующих веществ:
1) Реакции, протекающие без изменения состава вещества
А) получение
аллотропных модификаций одного химического элемента
эл.ток
3O2 → 2O3
12000С
Cграфит → Cалмаз
2500С
P4 ↔ Pкрасный
t0C
Sромбическая ↔ Sмоноклинная
Слайд 4
Б) реакции изомеризации – реакции, при которых из
исходного вещества образуется продукт с таким же количественным и
качественным составом, но другим строением
AICI3
CH3 – CH2 – CH2 – CH3 → CH3 – CH – CH3
│
CH3
5000C, SiO2
CH3 – CH2 – CH = CH2 → CH3 – CH = CH – CH3
2500C, AI2O3
CH3 – CH2 – CH = CH2 → CH3 – C= CH2
│
CH3
Слайд 5
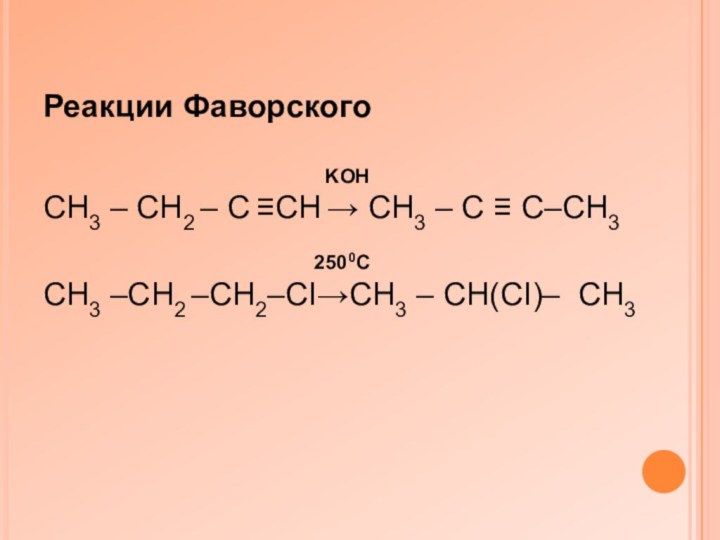
Реакции Фаворского
KOH
CH3 – CH2 – C ≡CH → CH3 – C ≡ C–CH3
2500C
CH3 –CH2 –CH2–CI→CH3 – CH(CI)– CH3
Слайд 6
2) Реакции, протекающие с изменением состава вещества
А) реакции
соединения – это реакции, при которых из двух или
более веществ образуется одно более сложное вещество
горение фосфора 4P+5O2 = 2P2O5
получение фосгена CO + CI2 = COCI2
гашение извести CaO + H2O = Ca(OH)2
получение азотной кислоты
4NO2 + 2H2O + O2 = 4HNO3
Слайд 7
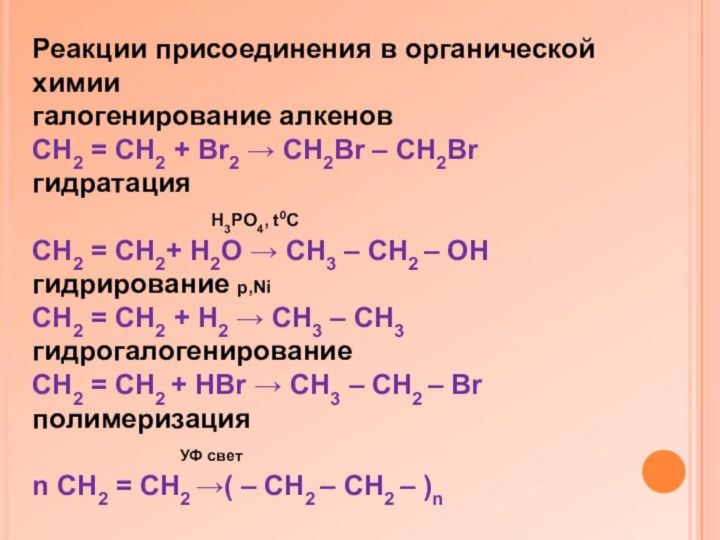
Реакции присоединения в органической химии
галогенирование алкенов
CH2 =
CH2 + Br2 → CH2Br – CH2Br
гидратация
H3PO4, t0C
CH2 = CH2+ H2O → CH3 – CH2 – OH
гидрирование p,Ni
CH2 = CH2 + H2 → CH3 – CH3
гидрогалогенирование
CH2 = CH2 + HBr → CH3 – CH2 – Br
полимеризация
УФ свет
n CH2 = CH2 →( – CH2 – CH2 – )n
Слайд 8
Б) реакции разложения – это реакции, при которых
из одного сложного вещества образуется несколько новых веществ
получение кислорода
в лаборатории
эл.ток
2H2O = 2H2 + O2
t0C, MnO2
2KCIO3 = 2KCI + 3O2
t0C
2KMnO4 = K2MnO4 + MnO2 + O2
Слайд 9
реакции отщепления (элиминирования) в органической химии
дегалогенирование дигалогеналканов
CH2Br – CH2Br – CH3 + Zn → CH2=
CH – CH3 + ZnBr2
дегидратация спиртов
CH3 –CH(OH) –CH2 –CH3 → CH3 –CH =CH –CH3 + H2O
дегидрирование алканов
CH3 – CH3 → CH3 – CH3 + H2
дегидрогалогенирование галогеналканов
CH3 – CHCI – CH2 – CH3 + KOH → CH3 – CH = CH – CH3 + KCI + H2O
крекинг алканов
CH3 – CH2 – CH3 → CH4 + CH2 =CH2
Слайд 10
В) реакции замещения – это реакции, в результате
которых атомы простого вещества замещают атомы одного из элементов
в сложном веществе
в неорганической химии это общие свойства металлов
2K + 2H2O = 2KOH + H2
Fe + 2HCI = FeCI2 + H2
2AI + 3CuCI2 = 2AICI3 + 3Cu
2AI + Cr2O3 = AI2O3 +2Cr
Слайд 11
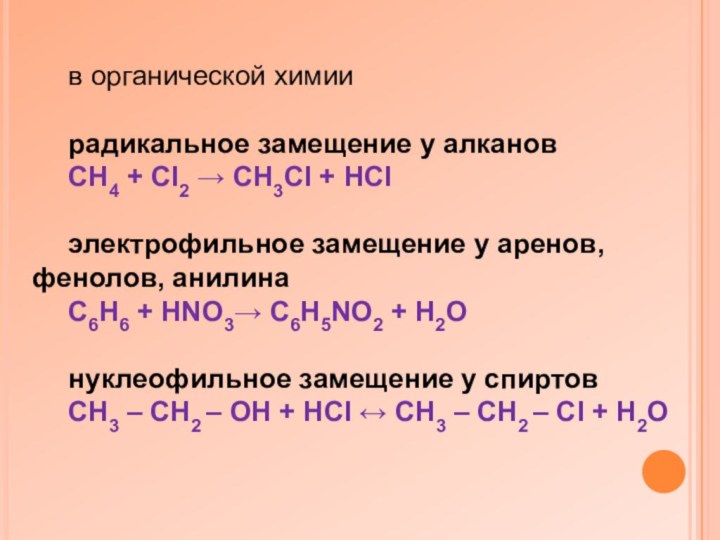
в органической химии
радикальное замещение у алканов
CH4 +
CI2 → CH3CI + HCI
электрофильное замещение у аренов, фенолов,
анилина
C6H6 + HNO3→ C6H5NO2 + H2O
нуклеофильное замещение у спиртов
CH3 – CH2 – OH + HCI ↔ CH3 – CH2 – CI + H2O
Слайд 12
Г) реакции обмена – это реакции при которых,
два сложных вещества обмениваются своими составными частями.
В растворах такие
реакции протекают по правилу Бертолле (проходят, если в результате реакции образуется осадок, газ или вода)
В неорганической химии свойства щелочей
2NaOH + H2SO4 = Na2SO4 + 2H2O
2NaOH + CuCI2 = Cu(OH)2 ↓ + Na2SO4
2NaOH + SO3 = Na2SO4 + H2O
Слайд 13
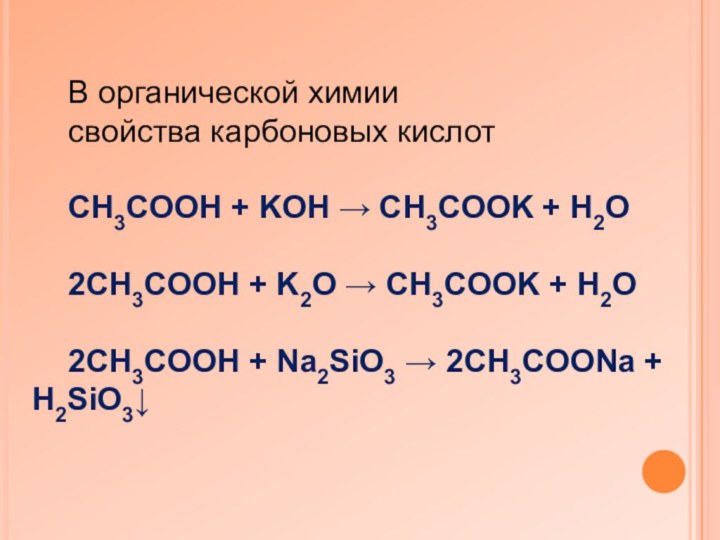
В органической химии
свойства карбоновых кислот
CH3COOH + KOH
→ CH3COOK + H2O
2CH3COOH + K2O → CH3COOK +
H2O
2CH3COOH + Na2SiO3 → 2CH3COONa + H2SiO3↓
Слайд 14
II. Классификация химических реакций по изменению степени окисления
элементов, образующих реагирующие вещества
1) реакции, идущие с изменением степени
окисления элементов, образующих реагирующие вещества или ОВР
(это реакции замещения, соединения, разложения с участием простых веществ)
Na2SO3 + KMnO4 + H2SO4= Na2SO4 + MnSO4 + K2SO4 + H2O
CH2= CH2 + KMnO4 + H2O → CH2(OH)-CH2(OH) + MnO2 + KOH
Слайд 15
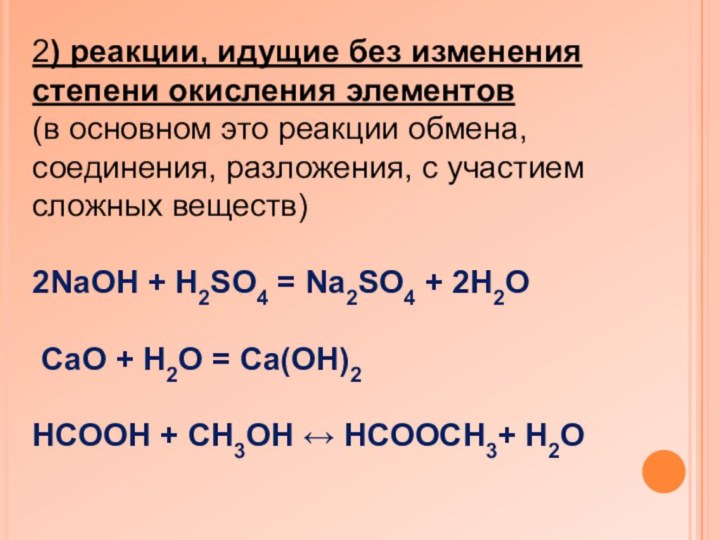
2) реакции, идущие без изменения степени окисления элементов
(в
основном это реакции обмена, соединения, разложения, с участием сложных
веществ)
2NaOH + H2SO4 = Na2SO4 + 2H2O
CaO + H2O = Ca(OH)2
HCOOH + CH3OH ↔ HCOOCH3+ H2O
Слайд 16
III. Классификация химических реакций по тепловому эффекту
1) Экзотермические
реакции – реакции, протекающие с выделением тепловой энергии (почти
все реакции соединения, кроме
N2 + O2 = 2NO –Q , H2 + I2 =2HI – Q)
Экзотермические реакции, протекающие с выделением света называются реакциями горения 2C6H6 + 15O2 → 12CO2 +6H2O + Q
2) Эндотермические реакции – реакции, протекающие с поглощением теплоты (в основном реакции разложения) CaCO3 = CaO + CO2
Количество выделенной или поглощенной теплоты называется тепловым эффектом реакции. Уравнение химической реакции, в которой указан тепловой эффект, называется термохимическим уравнением.
Слайд 17
IV. Классификация химических реакций по агрегатному состоянию реагирующих
веществ (фазовому состоянию)
Гетерогенные реакции – реакции, в которых реагирующие
вещества и продукты реакции находятся в разных агрегатных состояниях
CaC2(т) + 2H2O(ж) = C2H2↑+ Ca(OH)2(р-р)
2) Гомогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном сомотоянии
H2(г) + F2(г) = 2HF(г)
Слайд 18
V. Классификация химических реакций по участию катализатора
Каталитические, идущие
с участием катализатора
MnO2
2H2O2 =
2H2O + O2↑
2) Некаталитические, идущие без участия катализатора
2HgO= 2Hg + O2↑
Слайд 19
VI. Классификация химических реакций по направлению
1) Необратимые реакции
– реакции, которые протекают при данных условиях в одном
направлении
(реакции обмена, протекающие по правилу Бертолле)
KOH + HCI = KCI + H2O
2) Обратимые – это реакции, которые при одних и тех же условиях протекают в двух противоположных направлениях
2SO2 + O2↔ 2SO3
Слайд 20
VII. Классификация химических реакций по механизму
1) радикальные –
реакции, которые проходят при участии частиц радикалов
радикальная полимеризация
2) ионные
– реакции, которые идут между имеющимися или образующимися в ходе реакции ионами
электрофильное замещение у аренов
Слайд 21
VIII. Классификация химических реакций по виду энергии, инициирующей
реагент
Фотохимические
H2 + CI2 =2HCI
2) Электрохимические
2H2O = 2H2
+ O2
3)Термохимические
2KNO3 = 2KNO2 + O2
4) Радиохимические
радиовулканизация
Слайд 22
РАБОТА В КЛАССЕ С УЧЕБНИКОМ:
Учебника Рудзитис. Химия 11
класс: выполнить письменно задания с 58 №1,3,6.