Слайд 2
ЦЕЛИ УРОКА:
ЗАКРЕПИТЬ И УГЛУБИТЬ ЗНАНИЯ О СУЩНОСТИ
ОВР;
ПОЗНАКОМИТЬСЯ С МЕТОДОМ ПОЛУРЕАКЦИЙ И ЕГО ПРИМЕНЕНИЕМ В НЕОРГАНИЧЕСКОЙ
И ОРГАНИЧЕСКОЙ ХИМИИ
НАУЧИТЬСЯ СОСТАВЛЯТЬ УРАВНЕНИЯ ОВР С ИСПОЛЬЗОВАНИЕМ МЕТОДА ЭЛЕКТРОННО-ИОННОГО БАЛАНСА;
РАЗВИТЬ НАВЫКИ В ИСПОЛЬЗОВАНИИ МЕТОДА Э.И.Б. ДЛЯ РЕШЕНИЯ РАЗЛИЧНЫХ ТИПОВ ЗАДАЧ, УПРАЖНЕНИЙ, ТЕСТОВ .
Слайд 3
Продолжите…
Окислительно-восстановительные реакции – это реакции……в ходе которых хотя
бы один элемент изменил свою степень окисления
Окислитель – это….атом,
молекула или ион принимающий электроны. Во время реакции они восстанавливаются.
Восстановитель – это… атом, молекула или ион отдающий электроны. Во время реакции они окисляются.
Слайд 4
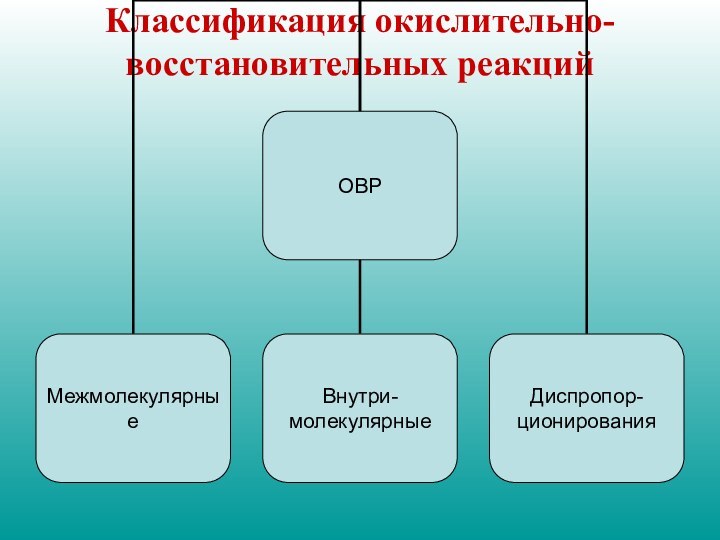
Классификация окислительно-восстановительных реакций
Слайд 5
Выполните задание
Допишите уравнения реакций, расставьте коэффициенты методом электронного
баланса
С6C5CH3 + KMnO4 + H2SO4 → C6H5COOH + ..+..+..
K2Cr2O7
+ K2S + H2O → S↓ +..+..
Слайд 6
МЕТОДЫ СОСТАВЛЕНИЯ ОВР
Метод электронного баланса
Метод электронно -
ионного баланса
Метод Гарсиа
Метод валентных связей
Слайд 7
Основное требование
Число электронов, отданных восстановителем
=
числу электронов,
принятых окислителем
Слайд 8
Электронно- ионный метод
(МЕТОД ПОЛУРЕАКЦИЙ)
Преимущество:
при составлении полуреакций
рассматриваются
реально
существующие
в растворе ионы и наглядно видна роль среды.
Слайд 9
МЕТОД ПОЛУРЕАКЦИЙ:
Алгоритм
1. Записать в ионном виде восстановитель, окислитель
и продукты их взаимодействия:
Сильные электролиты записывают в
виде ионов, а
слабые электролиты -
газы↑,
нерастворимые вещества↓ - в виде молекул.
Слайд 10
II. При составлении полуреакций окисления и восстановления следует
учитывать следующее:
1. Если исходное вещество содержит больше атомов
кислорода, чем продукт реакции, то освобождающийся кислород в форме О-2 связывается в кислых растворах ионами водорода (Н+) - в воду в нейтральных и щелочных растворах - в гидроксид-ионы.
В кислых растворах: О-2 + 2Н+ = Н2О
В нейтральных растворах: О-2 + Н+ (НОН) = ОН-
В щелочных растворах : О-2 + НOH = 2ОН-
Слайд 11
алгоритм
2. Если исходное вещество содержит меньше атомов кислорода,
чем продукты реакции, то недостаток их восполняется в кислых
и нейтральных растворах за счёт молекул воды ,в щелочных - за счёт гидроксид-анионов.
В кислых растворах : Н2О = О-2 + 2Н+
В нейтральных растворах: Н2О = О-2 + 2 Н+
В щелочных растворах: 2ОН- = О-2 + Н2О
Слайд 12
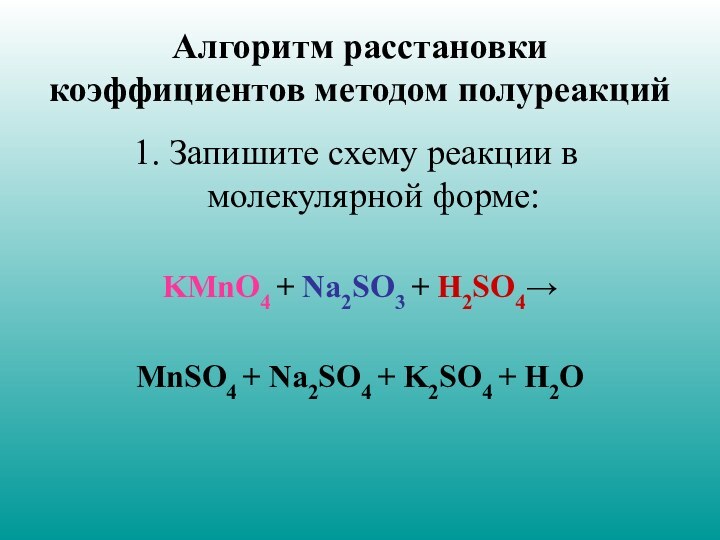
Алгоритм расстановки коэффициентов методом полуреакций
Запишите схему реакции в
молекулярной форме:
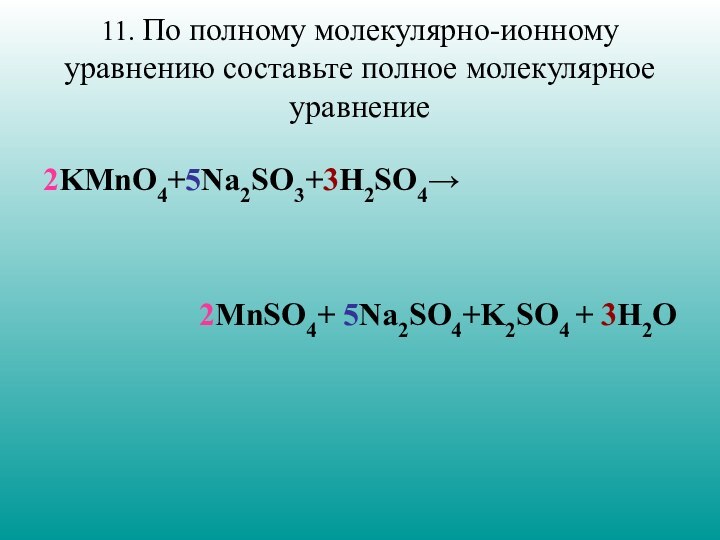
KMnO4 + Na2SO3 + H2SO4→
MnSO4 + Na2SO4 +
K2SO4 + H2O
Слайд 13
2. Составьте схему реакции в полной ионной форме,
подчеркнув восстановитель и окислитель
K+ + MnO4- + 2Na+ +
SO32- + 2 H+ + SO42-→
Mn 2+ + SO42- +2Na+ + SO42-+2 K+ + SO42- +H2O
Слайд 14
3. Составьте сокращенную
молекулярно-ионную схему
MnO4- + SO32-
+ 2 H+ + SO42-→Mn 2+ + SO42- +
SO42-+ K+ + SO42- +H2O
Слайд 15
4. Определите характер среды –
кислая, щелочная, нейтральная
Наличие
Н+ – среда кислая
Слайд 16
5. Выписать частицы,
изменившие состав и заряд:
MnO4- →
Mn 2+
SO32- → SO42-
Слайд 17
6. Составьте молекулярно-ионные уравнения для процессов окисления и
восстановления с учетом характера среды
Проверьте число атомов (О) в
левой и правой частях уравнений
- Проверьте число атомов каждого элемента
MnO4-+8H+=Mn2++4H2O
SO32-+H2O=SO42-+2H+
Слайд 18
Проверьте суммы зарядов ионов в левой и правой
частях молекулярно-ионных уравнений:
Если сумма зарядов исходных частиц больше суммы
зарядов продуктов реакции, то к левой части надо добавить соответствующее число электронов, а если меньше — вычесть
Слайд 19
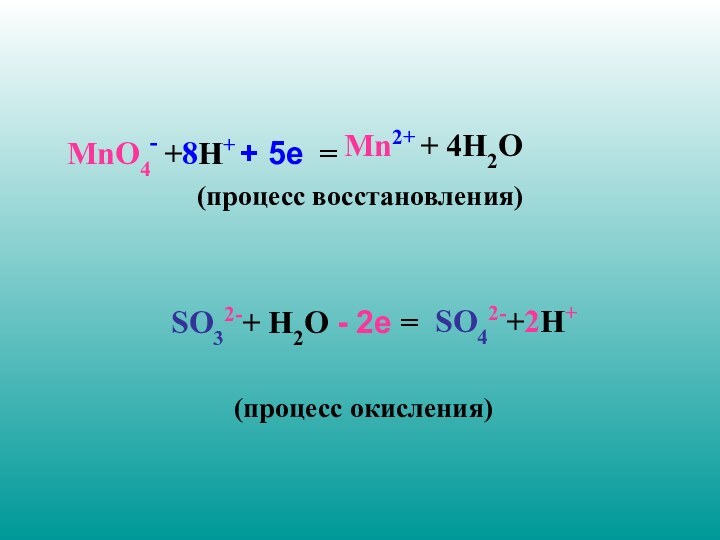
MnO4- +8H+ + 5е =
(процесс
восстановления)
SO32-+ H2O - 2е =
(процесс окисления)
SO42-+2H+
Mn2+ + 4H2O
Слайд 20
8. Найдите коэффициенты восстановителя, окислителя и продуктов их
превращения.
Умножьте левую и правую части обоих уравнений на
найденные коэффициенты
MnO4-+ 8H+ + 5е = Mn2++4H2O
SO32-+ H2O - 2е = SO42-+2H+
2
5
Слайд 21
Составьте сокращенное ионное уравнение окислительно-восстановительной реакции.
Для этого:
сложите уравнения полуреакций
сократите, если имеются, одинаковые частицы
добавьте в левую часть уравнения необходимое число сопутствующих противоположно заряженных ионов (см. стрелки)
то же число тех же ионов добавьте в правую часть уравнения
Слайд 22
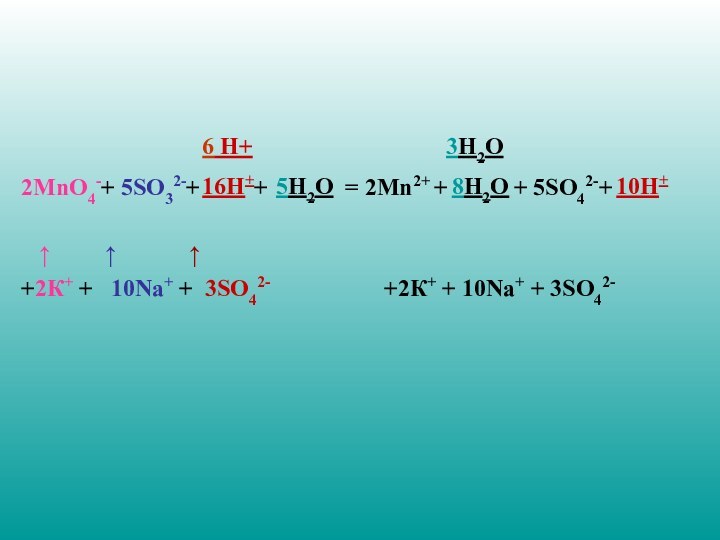
2MnO4-+ 5SO32-+ +
= 2Mn2+ +
+ 5SO42-+
↑ ↑ ↑
+2К+ + 10Nа+ + 3SO42- +2К+ + 10Nа+ + 3SO42-
6 H+
16H+
5H2O
8H2O
10H+
3H2O
Слайд 23
10. Составьте полное молекулярно-ионное уравнение
2К+ +2MnO4-+ 10Nа+ +
5SO32-+6H+ + 3SO42- =
= 2Mn2++ 2К+ + 10Nа+
+ 8SO42- + 3H2O