- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Непредельные углеводороды
Содержание
- 2. Непредельные углеводороды.Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи(>C=C
- 3. Непредельные углеводороды:Алкены.Алкадиены.Алкины.
- 4. АлкеныОпределение алкеновИзомерияНоменклатураХимическиесвойстваПолучениеПрименениеФизические свойстваНазад
- 5. Алкены ( олефины, этиленовые УВ) CnH2n,
- 6. ИзомерияДля алкенов возможны 4 типа изомерии:Изомерия углеродной цепиИзомерия положения двойной связиЦис,- транс- изомерияКлассов соединений (циклоалканы)Назад
- 7. НоменклатураCnH2nан -- ен или илен В качестве главной
- 8. Физические свойстваС2-С4 газы, С5-С16 жидкости, С>19 твердые, рTкип.(разв.)Ткип.(цис)>Tкип.(транс)Назад
- 9. Химические свойстваАктивны из-за наличия непрочной π- связиХарактерны
- 10. Присоединение галогенводородов к несимметричным алкенам происходит по
- 11. б) неполное( недостаток кислорода) C2H4
- 12. III.Реакции полимеризации.Процесс полимеризации алкенов открыт А.М.Бутлеровым.Полимеризацией называется
- 13. Исследования выдающегося русского химика Владимира Васильевича
- 14. Реакция Вагнера.
- 15. Получение алкенов. 1)Крекинг нефтепродуктов С16Н34
- 16. 5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой
- 17. Применение алкенов
- 18. Правило ЗайцеваЭта закономерность открыта в 1875 г.
- 19. Алкены.Назовите по систематической номенклатуре:
- 20. Домашнее задание.Цветков Хомченко № 20.1,20.2, 20.6(изомерия и номенклатура),2013,20.14,20.33,20.34.Журин А. Левина Л. с.31 № 52.
- 21. АлкадиеныПонятие алкадиеновКлассификацияИзомерия и номенклатураХимические свойстваПолучениеНазад
- 22. Диеновые углеводороды (алкадиены)Диеновые УВ (алкадиены) – это
- 23. Классификация Диены с кумулированными
- 24. Изомерия и номенклатура1)Структурная изомерия цепи
- 25. Химические свойства1) Реакции присоединения:
- 26. Получение алкадиенов1)Каталитическое дегидрирование а) алканов
- 27. В начале ХХ в. в связи с
- 28. Победителем оказалась группа химиков под руководством профессора
- 29. Понятие о терпенахКаучук- не единственное природное производное
- 30. Эфирными маслами называют нерастворимые в воде маслообразные
- 31. β-каротин содержит длинную цепочку сопряженных двойных связей.
- 32. Алкадиены 1. Укажите число - связей в
- 33. АлкиныОпределение алкиновИзомерияНоменклатураХимическиесвойстваПолучениеПрименениеФизические свойстваНазад
- 34. Алкины (ацетиленовые УВ)Алкины – это углеводороды, в
- 35. ИзомерияУглеродного скелета с «С» >5
- 36. Номенклатура АН → ИНВыбор
- 37. Физические свойстваС2-С4-газы, С5-С16-жидкости,С>17 твердые вещества, растворимость в
- 38. Химические свойства алкинов.Алкины во многих реакциях обладают
- 39. I.Реакции присоединения: 1.Присоединение водорода (гидрирование) На I
- 40. 3.Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются
- 41. Реакция с KMnO4 является качественной реакцией на алкины. Раствор KMnO4 обесцвечивается.
- 42. Кислотные свойства ацетиленовых
- 43. III. Реакции полимеризации. Очень длинные цепи молекулы
- 44. !!!В 1955г. Д. Натта с сотрудниками синтезировал
- 45. Получение алкиновПиролиз метана (метановый способ) .В
- 46. Применение ацетилена
- 47. Скачать презентацию
- 48. Похожие презентации
Непредельные углеводороды.Непредельные, или ненасыщенные, УВ содержат кратные углерод- углеродные связи(>C=C













































Слайд 2
Непредельные углеводороды.
Непредельные, или ненасыщенные, УВ содержат кратные углерод-
углеродные связи
атомы углерода, связанные между собой двойными или тройными связями. Их также называют ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чем насыщенные.
Слайд 4
Алкены
Определение
алкенов
Изомерия
Номенклатура
Химические
свойства
Получение
Применение
Физические
свойства
Назад
Слайд 5
Алкены ( олефины, этиленовые УВ) CnH2n, n>2
Алкены
– это УВ, в молекулах которых два атома углерода
находятся в состоянии Sp²-гибридизации и связаны друг с другом двойной связью.Длина связи С=С в алкенах равна 0,134 нм.
Назад
Слайд 6
Изомерия
Для алкенов возможны 4 типа изомерии:
Изомерия углеродной цепи
Изомерия
положения двойной связи
Цис,- транс- изомерия
Классов соединений (циклоалканы)
Назад
Слайд 7
Номенклатура
CnH2n
ан -- ен или илен
В качестве главной выбирают
цепь, включающую двойную связь, даже если она не самая
длинная.Нумерация с того конца, к которому ближе двойная связь
Положение = связи указывают в конце, номером атома углерода, после которого она находится.
В начале названия – положение боковых цепей.
Исключение: пентан - пентен или амилен
Радикалы СН2=СН- винил
СН2=СН-СН2- аллил
Назад
Слайд 8
Физические свойства
С2-С4 газы,
С5-С16 жидкости,
С>19 твердые,
рTкип.(разв.)
Ткип.(цис)>Tкип.(транс)
Назад
Слайд 9
Химические свойства
Активны из-за наличия непрочной π- связи
Характерны реакции
присоединения
Гидрирование( присоединение водорода)
СН3-СН=СН2 +Н2→ CH3-CH2-CH3(кат.Ni)
пропен пропанГалогенирование( +Hal2 )
СН3-СН=СН2 +Br2 → CH3-CHBr-CH2Br
пропен 1,2- дибромпропан
качественная реакция
Гидрогалогенирование( +HHal)
CH2=CH2 + HCl→ CH3 – CH2Cl
этен хлорэтан
Слайд 10 Присоединение галогенводородов к несимметричным алкенам происходит по правилу
В.В. Марковникова
Правило Марковникова
!!!При присоединении полярных молекул (НHal, H2O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода.
CH3-CH=CH2 +HBr →CH3-CHBr-CH3
пропен 2-бромпропан
Гидратация (+Н2О) происходит по правилу Марковникова
СН2=СН2 +Н2О →СН3-СН2ОН (в кислой среде при нагревании) этанол (первичный спирт)
СН2=СН-СН2-СН3+Н2О→СН3-СНОН-СН2-СН3
бутен-1 бутанол-2 ( вторичный спирт )
II. Реакция окисления
Горение: а) полное ( избыток О2)
С2Н4 +3О2 → 2СО2 +2Н2О
Слайд 11
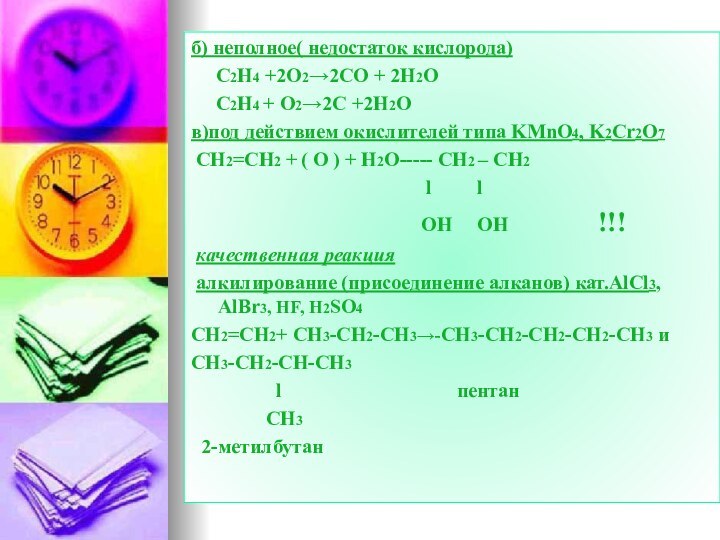
б) неполное( недостаток кислорода)
C2H4 +2O2→2CO
+ 2H2O
C2H4 + O2→2C +2H2O
в)под действием
окислителей типа KMnO4, K2Cr2O7CH2=CH2 + ( O ) + H2O----- CH2 – CH2
l l
OH OH !!!
качественная реакция
алкилирование (присоединение алканов) кат.AlCl3, AlBr3, HF, H2SO4
CH2=CH2+ CH3-CH2-CH3→-CH3-CH2-CH2-CH2-CH3 и
СH3-CH2-CH-CH3
l пентан
CH3
2-метилбутан
Слайд 12
III.Реакции полимеризации.
Процесс полимеризации алкенов открыт А.М.Бутлеровым.
Полимеризацией называется процесс
соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных
связей, с образованием высокомолекулярного соединения (полимера)Условия t, P, kat.
n CH2=CH2 → (-CH2-CH2-) n
мономер (этилен) полимер ( полиэтилен)
Назад
Слайд 13 Исследования выдающегося русского химика Владимира Васильевича Марковникова
явились блестящим подтверждением теории химического строения его учителя, А.М.
Бутлерова. Результаты этих исследований послужили основой учения о взаимном влиянии атомов как одного из главных положений теории химического строения. В 1869 г. В.В. Марковников защитил докторскую диссертацию на тему « Материалы по вопросу о взаимном влиянии атомов в химических соединениях».!!!
Слайд 14 Реакция Вагнера.
!
Реакцию окисления олефинов водным раствором перманганата калия открыл в
1888 г. русский химик с немецкой фамилией – Егор Егорович Вагнер. С помощью этой качественной реакции Е.Е. Вагнер доказал непредельный характер некоторых природных соединений: терпенов, лимонена, скипидара. С тех пор этот процесс носит имя ученого – реакция Вагнера.
Слайд 15
Получение алкенов.
1)Крекинг нефтепродуктов С16Н34 ---
С8Н18 + С8Н16( t )
2) Дегидрирование
алканов ( де + гидр + ирование= удалять +водород ++ действие) CnH2n+2 → CnH2n + H2 ( t, kat.) Отщепление водорода.
3) Гидрирование алкинов
CnH2n-2+ H2 → CnH2n ( kat. Ni, Pt )
4)Дегидратация спиртов (t, kat:H2SO4, H3PO4, Al2O3,
ZnCl2)
CH3-CH2OH →CH2=CH2 +H2O (170 , Н2SO4 конц.)
При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А.М. Зайцева). !!!
Слайд 16
5) Дегидрогалогенирование моногалогеналканов (-HHal)
действием твердой щелочи
или ее спиртового раствора. Происходит по правилу Зайцева:
СН3-СН2-С(СН3)Cl-CH3
+ KOH→CH3-CH=C(CH3)-CH3 +2-метил-2-хлорбутан 2-метилбутен-2
KCl + H2O !!!!
6) Дегалогенирование (-2Наl) дигалогеналканов с атомами галогена у соседних атомов «С»действием Z n или Mq.
CH3-CH2-CHBr-CHBr-CH3 + Zn →CH3-CH2-CH=CH-CH3 +ZnBr2
2,3-дибромпентан пентен-2
Вместо цинка может быть использован натрий или магний.
Назад
Слайд 18
Правило Зайцева
Эта закономерность открыта в 1875 г. выдающимся
русским химиком, учеником и тезкой А.М. Бутлерова Александром Михайловичем
Зайцевым и носит название правило Зайцева.Реакция дегидратации – полная аналогия реакции дегидрогалогенирования.
Де+ гидро +галоген + ирование =
удалять + водород+ галоген + (действие).
Отщепление галогеноводорода.
Дегидратация отщепление воды.
Слайд 19
Алкены.
Назовите по систематической номенклатуре:
СН2=СН-С(СН3)2СН3
а) 3,3 –диметилбутен-2, б)
2-диметилбутен -3,в) 2,2- диметилбутен -3, г) 3,3- диметилбутен-1
Бромэтан может быть превращен в этилен:
а) взаимодействием с натрием
б)взаимодействием со спиртовым раствором щелочи
в) нагреванием с серной кислотой
г) взаимодействием с водородом
Реакция присоединения воды называется
а)гидрирования б) дегидратация в) гидратация г) дегидрирования
Какие вещества,названия которых приведены ниже, являются между собой гомологами?
а) этен б) 2-метилпропен в) 1,2- дихлорпропен г) 1-хлорпропен
Укажите названия алкенов, для которых возможна геометрическая изомерия:
а) 1,1-дихлорэтен б) 1,2-дихлорэтен в) винилхлорид г) бутен -2
Укажите значение относительной молекулярной массы для алкена
с 6-ю атомами углерода в молекуле:
а) 86 б) 84 в) 82 г) 80
Укажите типы реакций, в которые может вступать пропен:
а) полимеризации б) гидратации в) гидрирования г ) окисления
В отличие от пропана пропен реагирует
а) бромом б) бромной водой в) водой г) водородом
Слайд 20
Домашнее задание.
Цветков
Хомченко № 20.1,20.2, 20.6(изомерия и номенклатура),2013,20.14,20.33,20.34.
Журин
А. Левина Л. с.31 № 52.
Слайд 21
Алкадиены
Понятие
алкадиенов
Классификация
Изомерия и
номенклатура
Химические
свойства
Получение
Назад
Слайд 22
Диеновые углеводороды (алкадиены)
Диеновые УВ (алкадиены) – это УВ,
в молекулах которых между атомами углерода имеются две двойные
связи.Общая формула:
CnH2n-2 , где n>3
Назад
Слайд 23
Классификация
Диены с кумулированными связями
Две двойные связи находятся у одного атома
углеродаСН2=С=СН2 пропадиен (аллен)
Диены с сопряженными связями
Двойные связи разделены одной одинарной связью
СН2=СН-СН=СН2 бутадиен-1,3
Диены с изолированными связями
Двойные связи разделены двумя или более одинарными связями
СН2=СН-СН2-СН=СН2 пентадиен-1,4
Назад
Слайд 24
Изомерия и номенклатура
1)Структурная изомерия цепи
СН3-СН=СН-СН=СН-СН3
гексадиен-2,4 СН3-СН=С(СН3)-СН=СН2
3 -метилпентадиен-1,3
2)Структурная изомерия взаимного положения двойных связей СН2=СН-СН2-СН=СН-СН3
гексадиен-1,4
СН2=СН-СН2-СН2-СН=СН2
гексадиен-1,5
3) Пространственная изомерия
4) Межклассовая изомерия СН=С-СН2-СН2-СН2-СН3
гексин-1 и его изомеры
Изомерия и номенклатура диенов на примере диенового углеводорода с эмпирической формулой С6Н10
Назад
цис-3-метилпентадиен- 1,3
транс-3-метилпентадиен- 1,3
Слайд 25
Химические свойства
1) Реакции присоединения:
а)
галогенирование
СН2=СН-СН=СН2+Br2(H2O)→CH2Br-CH=CH-CH2Br+
бутадиен-1,3
1,4-дибромбутен-2+ Br2(H20)→CH2Br-CHBr-CHBr-CH2Br
1,2,3,4-тетрабромбутан
Бромная вода обесцвечивается.
Присоединение идет в положение 1 и 4, а между атомами 2 и 3 образуется новая двойная связь.
б) гидрогалогенирование
СН2=СН-СН=СН2 +НCl →CH3-CH=CH-CH2Cl
бутадиен-1,3 1-хлорбутен -2
в)гидрирование ( +Н2)
СН2=СН-СН=СН2 +Н2 →СН3-СН=СН-СН3
бутадиен -1,3 бутен-2
2) Полимеризация
СН2=СН-СН=СН2 → (-СН2-СН=СН-СН2-)n
полибутадиен (бутадиеновый каучук)
Назад
Слайд 26
Получение алкадиенов
1)Каталитическое дегидрирование
а) алканов
СН3-СН2-СН2
–СН3 →СН2=СН-СН=СН2 +2Н2
(условия: Cr2O3/Al2O3,700)
б)алкенов
СН2=СН-СН2-СН3-→ СН2=СН-СН=СН2
+ Н22) По способу Лебедева.
2С2Н5ОН →СН2=СН-СН=СН2+2Н2О+Н2
!!!
Назад
Слайд 27 В начале ХХ в. в связи с резким
подорожанием натурального каучука возникла острая необходимость в разработке доступного
и экономичного способа получения диенов. В 1926 г. в Советском Союзе был объявлен конкурс на лучший способ получения синтетического каучука. Сроки и условия конкурса были достаточно жесткими.Слайд 28 Победителем оказалась группа химиков под руководством профессора Военно-медицинской
академии г. Ленинграда Сергея Васильевича Лебедева. В качестве сырья
использовался этиловый спирт. Этот способ получения бутадиена-1,3 получил название метода Лебедева и долгое время использовался в промышленности.
Слайд 29
Понятие о терпенах
Каучук- не единственное природное производное изопрена.
В природе существует множество углеводородов, структурными фрагментами которых является
изопрен. Общее «родовое» название терпены. Общая формула-(С5Н8)n. Терпены очень широко распространены в природе. Многие являются составной частью эфирных масел, придающих растениям специфический аромат. Оцимен содержится в базилике, а лимонен - в кожуре цитрусовых.Слайд 30 Эфирными маслами называют нерастворимые в воде маслообразные продукты,
которые в отличие от жирных масел полностью испаряются и
не оставляют следов на бумаге. Их используют в производстве душистых веществ, для ароматизации косметических средств. Первые рецептуры таких композиций относятся ко временам царя Хаммурапи (2100г. до н.э.) Сквален выделяют из печени акулы.Слайд 31 β-каротин содержит длинную цепочку сопряженных двойных связей. Такие
фрагменты называют хромофорными группами.
Подобные молекулы окрашивают в желтый цвет
лепестки шафрана, в золотой - сладкую кукурузу,
в оранжевый - апельсиновый сок,
в розовый - мясо лосося. β-каротин содержится в моркови, которая имеет такую характерную окраску. Витамины группы А - производные терпенов. При недостатке витамина А возникает ослабление зрения. Поэтому сырая морковь и морковный сок так полезны для глаз.
Слайд 32 Алкадиены 1. Укажите число - связей в молекуле 1,3-
бутадиена: а) 8 б) 9 в) 7 г) 5 2.Молярная
масса алкадиена равна 82 г/моль. Сколько атомов водорода содержится в молекуле алкадиена? а) 10 б) 12 в) 14 г) 8 3) В молекуле алкадиена 6 атомов углерода. Укажите значение относительной молекулярной массы алкадиена: а) 86 б) 84 в) 82 г) 80 4) Какой продукт преимущественно образуется при взаимодействии 1 моль 1,3- бутадиена с 1 моль брома при комнатной температуре а) 1,4 –дибромбутен-2 б) 1,2 –дибромбутен-1 в) 3,4 –дибромбутен-1 г) 1,2,3,4 – тетрабромбутан 5) Укажите схемы реакций, в которых продуктом может быть 1,3 –бутадиен а) СН3-СН(СН3) – СН2 –СН3 ---- (дегидрирование) б) СН3 –СН2 –СН2 СН3 ---( кат. t) в) 2 СН3 – СН2Cl + 2Na ---- ( t) г) 2С2 Н5ОН ----- (кат,t ) 6) С какими веществами реагирует 1,3 –бутадиен? а) бром б ) водород в ) кислород г ) хлороводород 7) При полном гидрировании бутадиена -1,3 образуется: а) бутен б) бутан в) изопрен г) бутен-2 8) Реакцией Лебедева называется реакция получения: а) 1.3- бутадиена из этилена б) 1,3 –бутадиена из винилхлорида в) 1,3 –бутадиена из бутана г) 1,3 –бутадиена из этанола 9) В результате вулканизации каучука можно получить: а) гуттаперчу б) резину в) эбонит г) фенопласт 10) Укажите формулу элементарного звена бутадиенового каучука: а) СН2=СН-СН=СН2 б) -СН2-СН-СН-СН2- в) -СН2-СН=СН-СН2 г ) -СН2=СН –СН=СН2-
Слайд 33
Алкины
Определение
алкинов
Изомерия
Номенклатура
Химические
свойства
Получение
Применение
Физические
свойства
Назад
Слайд 34
Алкины (ацетиленовые УВ)
Алкины – это углеводороды, в молекулах
которых два атома углерода находятся в состоянии SP-гибридизации и
связаны друг с другом тройной связью. Общая формула:CnH2n-2, n>2Длина связи в алкинах равна
0,120 нм.
Назад
Слайд 35
Изомерия
Углеродного скелета с «С» >5
CНΞС-СН2-СН2-СН3
СНΞС-СН –СН3
бутин-1 СН3
3-метилбутин-1
Положения тройной (кратной) связи
СНΞС-СН2-СН3 СН3-СΞС-СН3
бутин-1 бутин-2
Классов соединений (алкадиены)
СНΞС-СН2-СН3 СН2=СН-СН=СН2
бутин-1 бутадиен-1,3
Пространственной изомерии нет
Назад
Слайд 36
Номенклатура
АН → ИН
Выбор главной
цепи и начало нумерации определяется тройной связью
Правила составления названий
алкинов по международной номенклатуре аналогичны правилам для алкенов. Назад
Слайд 37
Физические свойства
С2-С4-газы, С5-С16-жидкости,С>17 твердые вещества, растворимость в воде
небольшая, но больше чем у алкенов и алканов, р
см,Ткип( Н) > Т кип (разв), с увеличением Мr Tкип увеличивается.
Назад
Слайд 38
Химические свойства алкинов.
Алкины во многих реакциях обладают большей
реакционной способностью,чем алкены. Для алкинов,как и для алкенов, характерны
реакции присоединения. Так как тройная связь содержит две π-связи, алкины могут вступать в реакции двойного присоединения (присоединять 2 молекулы реагента по тройной связи). Присоединение несимметричных реагентов к несимметричным алкинам происходит по правилу Марковникова.Слайд 39 I.Реакции присоединения: 1.Присоединение водорода (гидрирование) На I ступени образуются алкены,
на II cтупени- алканы: С 2 H 2
+ Н2 → СН2=СН2 (кат. Pt, Pd, Ni, t=150) CН2=СН2 +Н2→СН3-СН3 Суммарное уравнение: С 2Н 2+2Н2 →СН3-СН3 2.Присоединение галогенов (галогенирование) На I ступени образуются дигалогеналкены, на II- тетрагалогеналканы: С 4Н 6 + Br2→CН Br =С Br -СН2-СН3 бутин -1 ( Н2О) 1,2-дибромбутен-1 СНBr=СBr-СН2-СН3 +Br2---CHBr2-CBr2-CH2-CH3 ( H2O) 1,1,2,2-тетрабромбутан Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается.Слайд 40 3.Присоединение галогеноводородов (гидрогалогенирование) На I ступени образуются моногалогеналкены, на II
–дигалогеналканы: С 2Н 2 + НCl →CH2=CHCl+HCl→CH3-CHCl2
хлорэтен 1,1-дихлорэтан (Cu, Hg ) 4.Присоединение воды (гидратация) Происходит по правилу Марковникова. Ацетилен образует альдегид, его гомологи –кетоны (реакция М.Г. Кучерова): С 2Н2 + НОН→ СН3-СОН кат.Hg этаналь С 3Н4 + НОН→ СН3-С-СН3 О пропанон (ацетон)Слайд 42 Кислотные свойства ацетиленовых
углеводородов. Атом водорода в ацетилене и его гомологах, содержащих тройную
связь на конце молекулы, довольно подвижен. Он может замещаться на металл, связанный с органическим остатком ионной связью. Продукты замещения можно отнести к классу солей, они называются ацетиленидами. С 2Н2 + 2 Na--- C 2Na2 + H2 ( в присутствии NH3) Реакция получения ацетиленидов серебра и меди (I) позволяет отличить алкины с концевой тройной связью от алканов, алкенов и алкинов с тройной связью в середине углеродной цепи. С 2Н 2+ Ag2O --- C 2Ag 2 + H2O (хлопья серого осадка) Во влажном состоянии ацетиленид серебра безопасен, а при высыхании сильно взрывается от удара или поджигания.Слайд 43 III. Реакции полимеризации. Очень длинные цепи молекулы ацетилена образуют
с трудом, а вот несколько молекул (от двух до
пяти ) соединяются друг с другом относительно легко. Впервые подобную реакцию в 1866г. Осуществил М. Бертло. При нагревании ацетилена до 600 градусов С ему удалось получить небольшое количество бензола. Спустя 60 лет русский химик Николай Дмитриевич Зелинский обнаружил, что катализатором данной реакции является углерод (активированный уголь). С тех пор эта реакция носит имя Н.Д.Зелинского. 3С2Н2-----С6Н6 бензол НазадСлайд 44 !!!В 1955г. Д. Натта с сотрудниками синтезировал полиацетилен,
представлявший собой смесь цис-, трансизомеров: цис-полиацетилен, красного цвета, менее
устойчив, транс- полиацетилен, синего цвета, более устойчив. Полиацетилен открыл новую эру токопроводящих полимеров. В 1976г. в лаборатории японского ученого Хидэки Сиракавы было сделано удивительное открытие. Если пленку из этого материала обработать иодом, получается золотистое покрытие с металлическим блеском, которое проводит электрический ток в миллиард раз лучше, чем сам полиацетилен! Эти материалы используются в сотнях электронных и звуковоспроизводящих устройств.
Слайд 45
Получение алкинов
Пиролиз метана (метановый способ)
.В 1868
г. М. Бертло, пропуская через метан электрический разряд, обнаружил
в смеси образующихся газов ацетилен.2СН4 →С2Н2 + 3Н2
Дегидрогалогенирование дигалогеналканов
В 60-х гг.XIXв. Молодым русским ученым М. Мясникову и В. Савичу удалось получить ацетилен взаимодействием 1,2-дибромэтана с кипящим спиртовым раствором гидроксида калия
СН2Br-CH2Br +KOH (спирт. р-р) →CH2=CHBr +KBr +H2O
CH2=CHBr + KOH (спирт.р-р) →С2Н2 +KBr + H2O
Карбидный способ
В 1836г. английский химик Э.Дэви получил бесцветный газ, горящий красноватым коптящим пламенем при действии воды на карбид кальция
CaC2 + 2 H2O → Ca(OH)2 +C2H2 (ацетилен)
Назад