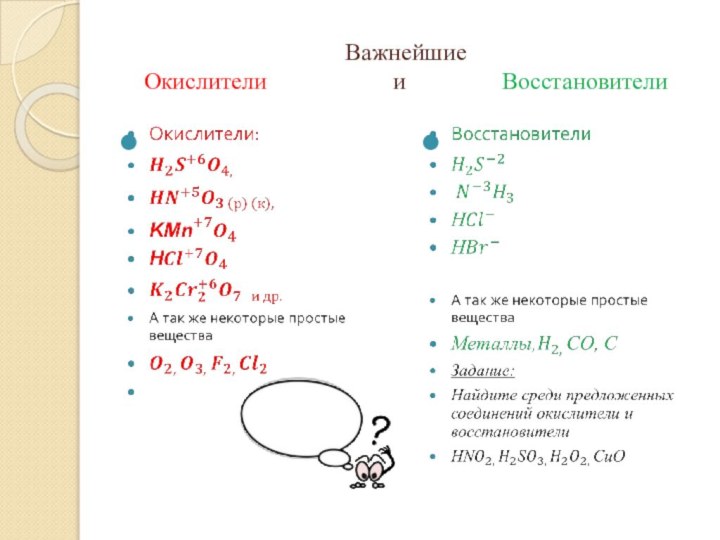
систематизировать знания учащихся о классификации химических реакций в свете
электронной теории;- научить объяснять основные понятия ОВР;
- дать классификацию ОВР
2. развивающие
- развивать умение наблюдать, делать выводы;
- продолжить развитие логического мышления, умений анализировать и сравнивать;
3. воспитательные
- формировать научное мировоззрение учащихся, совершенствовать трудовые навыки;
-воспитать умение слушать друг друга, анализировать ситуацию, совершенствовать культуру межличностного общения