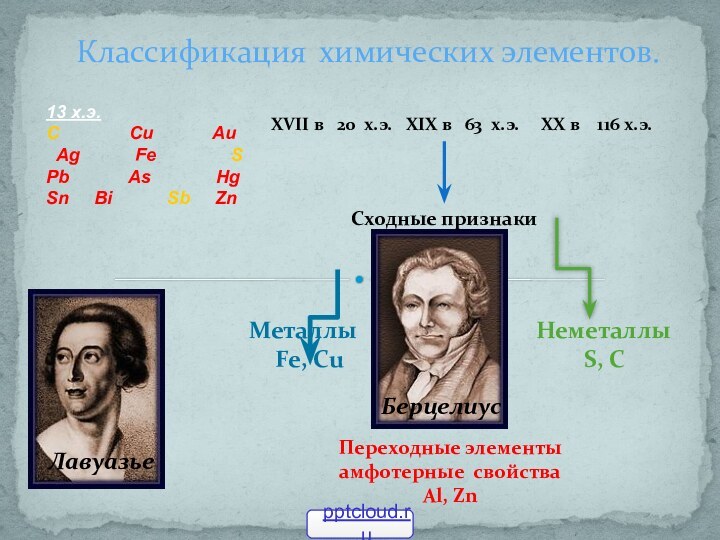
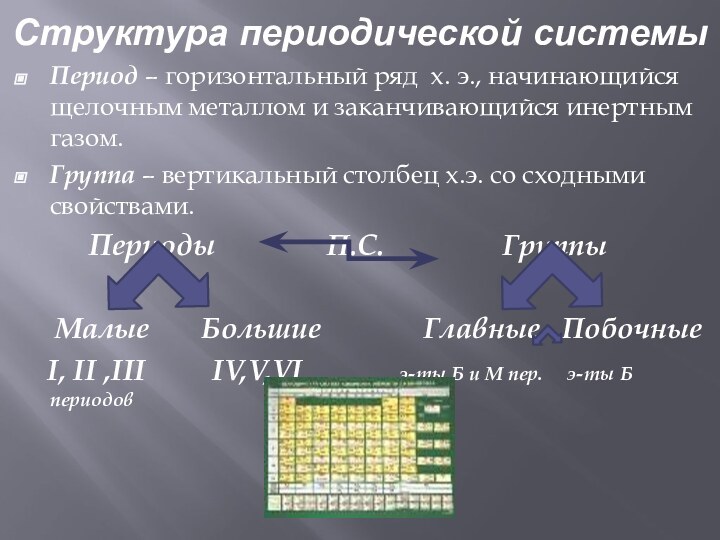
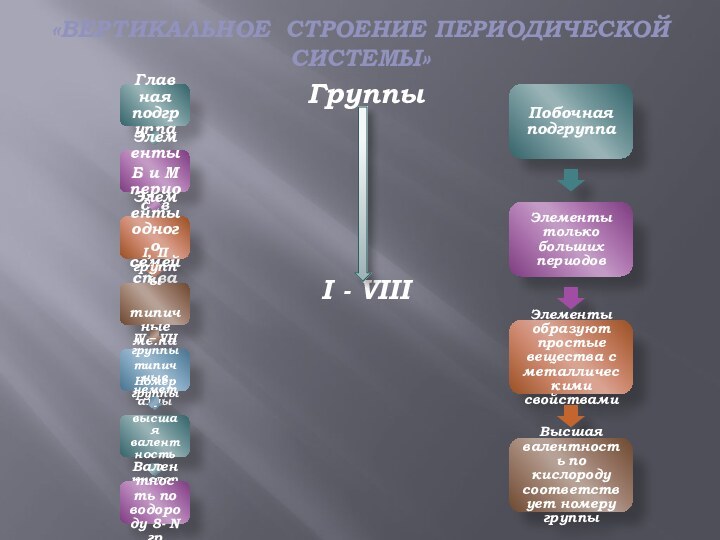
50)
Триады И. Деберейнера
(1829г.)
Триада- тройка сходных элементов .
Из известных в
то время химических элементов И. Деберейнеру удалось выделить три триады:CI – Br – I
K – Rb – Ba
Ca – Sr - Te
Ученый обнаружил, что атомный вес среднего элемента был близок среднему арифметическому атомных весов сходным с ним по химическим свойствам двух других крайних элементов.