Слайд 3
Что общего у достопримечательностей?
Слайд 4
Царь-пушка
1586 год
Автор Андрей Чохов.
Масса ствола – 40 т,
масса с лафетом – 80 т.
Длина – 5,34 м.
Предназначена
для стрельбы картечью.
Поверхность ствола украшена барельефами, в том числе изображением царя Федора Ивановича, в правление которого была изготовлена.
Слайд 5
Царь-колокол
1733 – 1735 г
Авторы Иван и Михаил Моторины.
Вес
200 т. Высота 6,14 м. Диаметр 6,6 м.
Сильно пострадал
во время тушения пожара в Московском Кремле в 1737 году, вес отколовшейся части – 11,5 т.
Водружен на постамент в 1836 году.
Слайд 6
«Медный всадник»
(Памятник Петру I в Санкт-Петербурге)
1765 –
1782 гг.
Автор Этьен Морис Фальконе
Масса скалы 275 т,
масса статуи 50 т, высота 5,3 м
Слайд 7
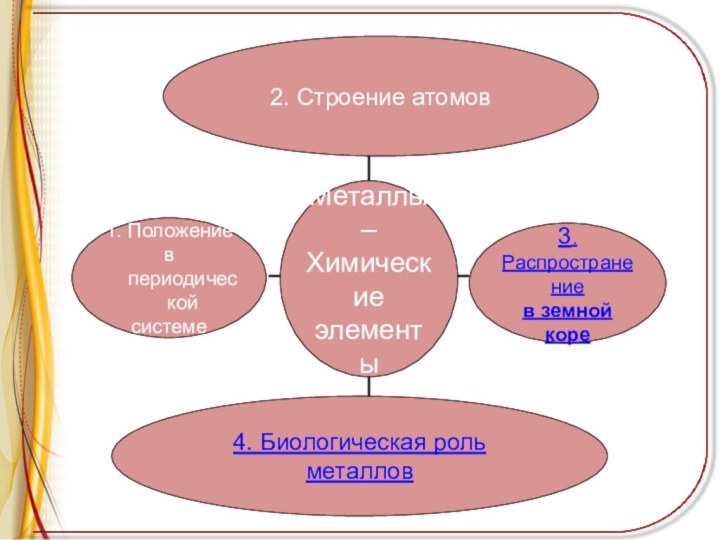
Представления о металлах
Существует гипотеза, что термин «металлы» произошел
от греч. «металлон», которое в первоначальном переводе означало «копи»,
«рудники»
Более 200 лет назад М.В.Ломоносов в труде «Первые основы металлургии» дал металлам такое определение: «Металлы суть ковкие блестящие тела»
Слайд 8
Металлы в алхимии
Золото – Солнце Серебро -
Луна
Медь – Венера ♀ Железо – Марс ♂
Олово
– Юпитер Свинец – Сатурн
Ртуть – Меркурий
Слайд 9
Ни едино художество,
ни едино ремесло простое употребления
металлов миновать не может.
М.В. Ломоносов
Тема урока: «Положение металлов в
Периодической системе химических элементов»
Слайд 10
Цель урока:
1. На основе положения металлов в ПСХЭ
прийти к пониманию особенностей строения их атомов и кристаллов
(металлической химической связи и кристаллической металлической решетки).
2.Обобщить и расширить знания о физических свойствах металлов и их классификаций.
3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
Слайд 12
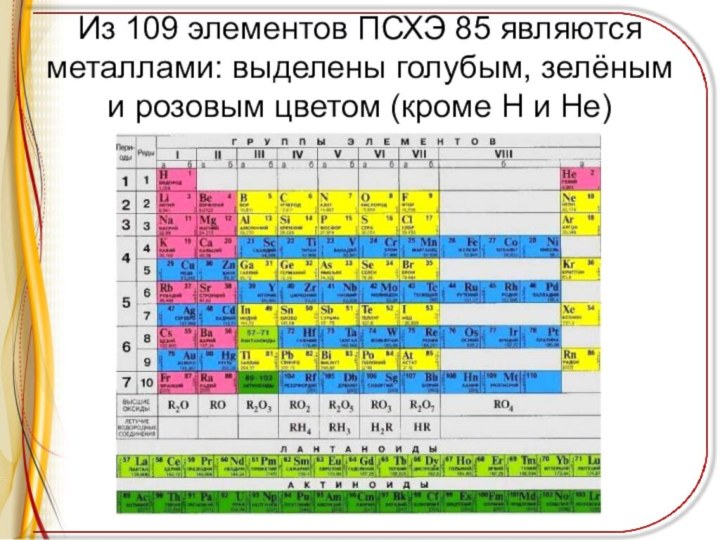
Из 109 элементов ПСХЭ 85 являются металлами: выделены
голубым, зелёным и розовым цветом (кроме H и He)
Слайд 13
Положение элемента в ПС отражает строение его атомов
Слайд 14
Самостоятельная работа
Прочитайте текст последнего абзаца
на стр. 28 . Ответьте на вопрос: какие особенности
строения присущи атомам металлов?
Слайд 15
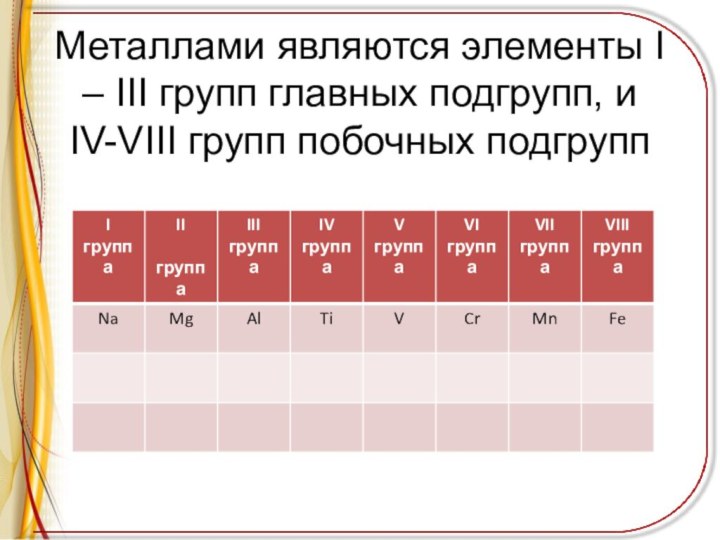
Металлами являются элементы I – III групп главных
подгрупп, и IV-VIII групп побочных подгрупп
Слайд 16
Металлы – это группа веществ с общими свойствами.
Слайд 17
Вывод:
1. Металлы– элементы, имеющие на внешнем энергетическом
уровне 1-3 электрона, реже 4-6.
2. Металлы – это химические
элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Слайд 18
Распространение металлов
в земной коре
В свободном (самородном) состоянии
встречаются только малоактивные металлы (медь, серебро, золото, платина и
некоторые другие)
Остальные металлы встречаются в природе в виде соединений - оксидов или солей: сульфидов, сульфатов, карбонатов, хлоридов, фосфатов, нитратов.
Слайд 19
Контрольное тестирование
1(А). Металлические свойства наиболее сильно выражены
у
1) бария
2) кальция 3) стронция 4) магния
2(А). Электронную формулу 1s22s22p63s23p64s2 имеет атом элемента
1) Na 2) Ca 3) Cu 4) Zn
3(А). В каком ряду элементы расположены в порядке ослабления восстановительных свойств?
1) Mg – Ca – Sr – Ba 3) Si – AI – Mg – Na
2) Fr – Cs – Rb – K 4) O – S – Se – Te
4*(В). В ряду Be – Mg – Ca химические элементы расположены в порядке
1) усиления металлических свойств
2) уменьшения числа электронных слоев в атоме
3) уменьшения заряда ядер атомов
4) увеличения числа электронов во внешнем электронном слое атомов
5) увеличения радиусов атомов