- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Вода как растворитель. Растворы. Растворенные вещества дисциплины ОУД.10 Химия, специальности 33.02.01 Фармация, СПО
Содержание
- 2. ЦЕЛЬ:
- 3. .Вода (оксид водорода) – бинарное неорганическое соединение
- 4. Агрегатные состояния:ЖидкостьГазТвёрдое вещество
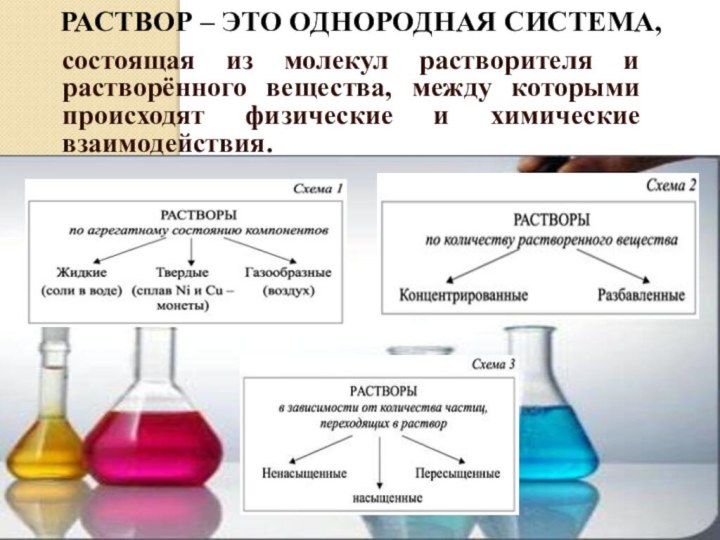
- 5. Раствор – это однородная система,состоящая из молекул
- 6. Взвеси- мутные смесиСуспензии-
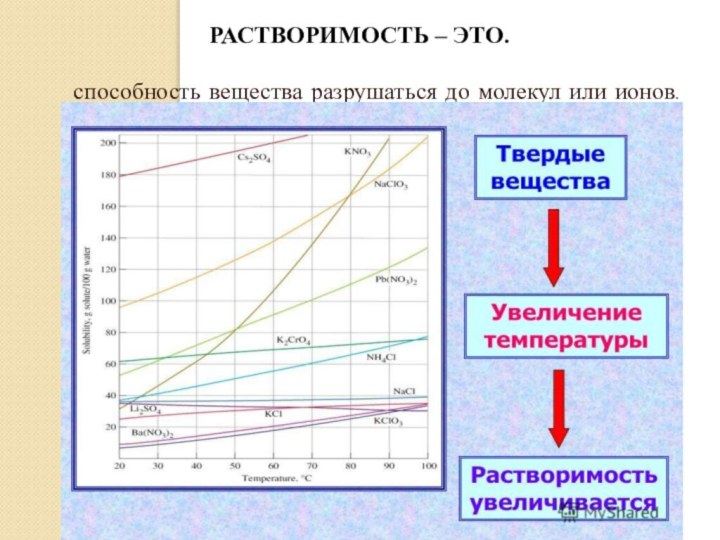
- 7. Растворимость – это. способность вещества разрушаться до молекул или ионов.
- 9. Массовая доля растворенного вещества:. ( Ѡ р.в.
- 10. Пример решения задачи:Поваренную соль массой 5 г
- 11. Решение: 1. m(раствора) = m(NaCl) + m(H2O)
- 12. Вывод:По завершению показа проекта, мы достигли заданную
- 13. Список используемых источниковАхметов Н.С. Общая и неорганическая
- 14. Скачать презентацию
- 15. Похожие презентации
ЦЕЛЬ: расширить представление о воде, как о растворители; процессе растворения, растворах и массовой доли растворенного вещества.





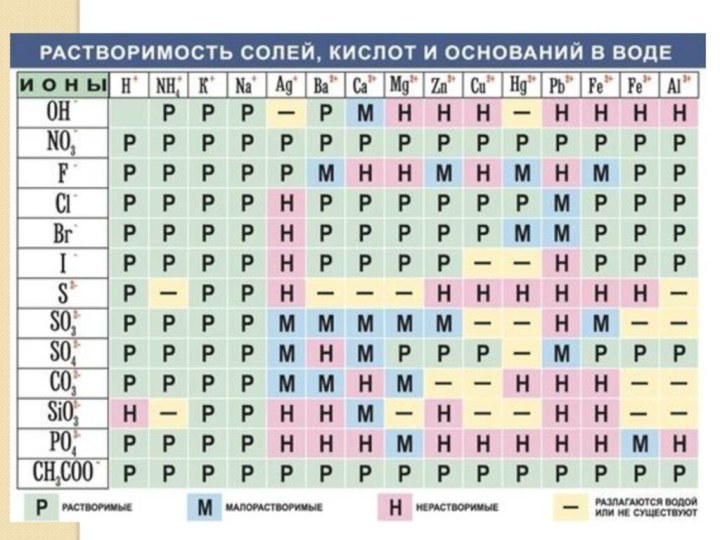





Слайд 3
.
Вода (оксид водорода) – бинарное неорганическое соединение с
химической формулой Н2О. Молекула воды состоит из двух атомов
водорода и одного кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета, запаха и вкуса. В твердом состоянии называется льдом, а в газообразном – водяным паром. Вода так же может существовать в виде жидких кристаллов.
Слайд 5
Раствор – это однородная система,
состоящая из молекул растворителя
и растворённого вещества, между которыми происходят физические и химические
взаимодействия.
Слайд 6
Взвеси- мутные смеси
Суспензии-
взвеси, в которых мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсии-
взвеси, в которых мелкие капельки какой- либо жидкости равномерно распределены между молекулами воды
Слайд 9
Массовая доля растворенного вещества:
.
( Ѡ р.в. )
- это безразмерная величина, равная отношению массы растворённого вещества
(m р. в.) к общей массе раствора (mр-ра ):m р. в.
Ѡ р.в. = ------------
mр-ра
m р-ра = m р.в. + m (н2о)
Слайд 10
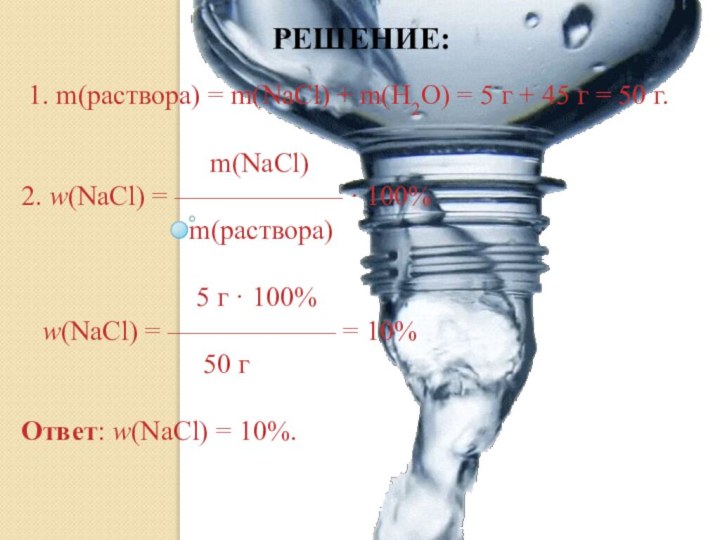
Пример решения задачи:
Поваренную соль массой 5 г растворили
в 45 г воды. Определите массовую долю (%) соли
в растворе.Дано:
m(NaCl) = 5 г
m(H2O) = 45 г
-----------
w(NaCl) - ?
Слайд 11
Решение:
1. m(раствора) = m(NaCl) + m(H2O) =
5 г + 45 г = 50 г.
m(NaCl)2. w(NaCl) = —————— · 100%
m(раствора)
5 г · 100%
w(NaCl) = —————— = 10%
50 г
Ответ: w(NaCl) = 10%.
Слайд 12
Вывод:
По завершению показа проекта, мы достигли заданную цель,
и узнали, что благодаря полярности молекул и способности образовывать
водородные связи вода легко растворяет ионные соединения (соли, кислоты, основания). Хорошо растворяются в воде и некоторые неионные, но полярные соединения. Когда вещество переходит в раствор, его молекулы или ионы могут двигаться более свободно и, следовательно, реакционная способность вещества возрастает. Это объясняет, почему вода является основной средой, в которой протекает большинство химических реакций, а все реакции гидролиза и многочисленные окислительно-восстановительные реакции идут при непосредственном участии воды.
Слайд 13
Список используемых источников
Ахметов Н.С. Общая и неорганическая химия
Коттон
Ф., Уилкинсон Дж. Основы неорганической химии
Реми Г. Курс неорганической
химии.www.rosinka.ru
www.xumuk.ru
www.o8ode.ru