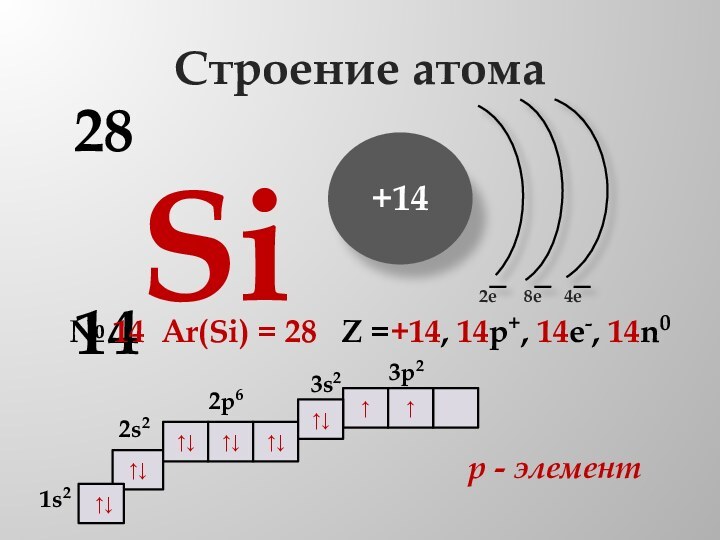
1s2
Строение атома
14Si
2e
4e
8e
№ 14 Ar(Si)
= 28 Z =+14, 14p+, 14e-, 14n0 р - элемент
↑↓
28
3p2
2p6
↑
2s2
3s2
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть






















р - элемент
↑↓
28
3p2
2p6
↑
2s2
3s2
Si- восстановитель
Si- окислитель
Это интересно!
Это интересно!