- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Азот , форсфор и их соединения
Содержание
- 2. ПланХимия соединений азотаПолучение азотаХимические свойства азотаХимия соединений фосфораПолучение фосфораХимические свойства фосфора
- 3. Химия соединений азотаОбщее содержание азота в земной
- 4. Химия соединений азота. Получение NH4NO2 = 2
- 5. Химические свойства азотаНаиболее характерным для азота валентным
- 6. Химические свойства азотаДля химической характеристики аммиака основное
- 7. Соединения азотаХлористый аммоний (“нашатырь”):4 МеО + 2
- 8. Соединения азота3 Сu2O + 2 NH3 =
- 9. Соединения азотаХлор и бром энергично реагирует с
- 10. Кислородные соединения азотаГемиоксид азота может быть получен
- 11. Кислородные соединения азотаОбразование монооксида азота из элементов
- 12. Кислородные соединения азотаХим св-ва NO :2 NO
- 13. Кислородные соединения азотаДиоксид азота:2 Рb(NO3)2 = 2
- 14. Азотная кислотаАзотную кислоту получают взаимодействием природной селитры
- 15. Азотная кислота (конц)Азотная кислота конц:С металлами железом
- 16. Азотная кислота (разб)При взаимодействии с щелочно-земельными металлами,
- 17. Химия соединений фосфораДоля около 0,04% от общего
- 18. Химия соединений фосфораПолучение фосфора1. Са3(РО4)2 + 8
- 19. Химия соединений фосфораФизические свойстваВ парах фосфор четырёхатомен
- 20. Химия соединений фосфораПрактически красный фосфор получают длительным нагреванием белого до 280340 С
- 21. Химия соединений фосфораХимическая активность фосфора значительно выше,
- 22. Химия соединений фосфораСа3Р2 + 6 Н2О =
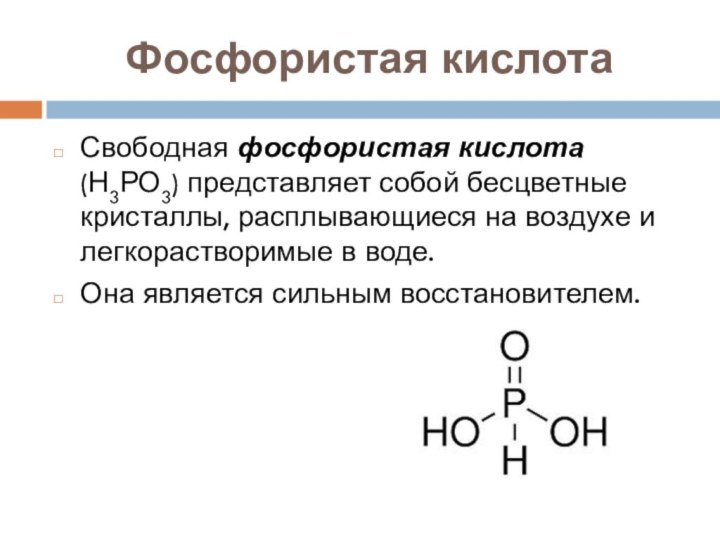
- 23. Фосфористая кислотаСвободная фосфористая кислота (Н3РО3) представляет собой
- 24. Ортофосфорная кислотаФосфорная кислота представляет собой бесцветные, расплывающиеся
- 25. Ортофосфорная кислотаНаличие у фосфорной кислоты заметных признаков
- 26. Скачать презентацию
- 27. Похожие презентации
ПланХимия соединений азотаПолучение азотаХимические свойства азотаХимия соединений фосфораПолучение фосфораХимические свойства фосфора
























Слайд 2
План
Химия соединений азота
Получение азота
Химические свойства азота
Химия соединений фосфора
Получение
фосфора
Слайд 3
Химия соединений азота
Общее содержание азота в земной коре
оценивается в 0,03%
основную массу (75,6 вес. %) составляет свободный
азот (N2)Атом азота в основном состоянии имеет структуру внешнего электронного слоя 2s22p3 и трёхвалентен.
Слайд 5
Химические свойства азота
Наиболее характерным для азота валентным состояниям
отвечают значения –3, 0, +3 и +5.
Аммиак
N2 +
3 H2 2 NH3 + 92 кДжСмеси аммиака с воздухом, содержащие от 16 до 28 объёмн.% аммиака взрывоопасны.
Слайд 6
Химические свойства азота
Для химической характеристики аммиака основное значение
имеют реакции трёх типов: присоединения, замещения водорода и окисления
При
растворении аммиака в воде происходит частичное образование гидроксида аммония:NH3 + H2O NH4OH
NH3 + HCl = NH4Cl + 176 кДж (при полном отсутствии воды реакция эта не идёт)
Слайд 7
Соединения азота
Хлористый аммоний (“нашатырь”):
4 МеО + 2 NH4Cl
= 4 H2O + N2 + MeCl2 + 3
MeMeO + 2 NH4Cl = MeCl2 + 2 NH3 + H2O.
Взрывной распад NH4NO3 (аммиачная селитра) протекает в основном по уравнению:
2 NH4NO3 = 4 H2O + N2 + O2 + 238 кДж
2 Аl + 2 NH3 = 2 AlN + 3 H2 + 389 кДж
Горение : 4 NH3 + 3 O2 = 6 H2O + 2 N2 + 1267 кДж.
Нитриды: Mg3N2 + 6 H2O = 3 Mg(OH)2 + 2 NH3.
Слайд 8
Соединения азота
3 Сu2O + 2 NH3 = 3
H2O + 2 Cu3N или
CrCl3 + NH3 = 3
HCl + CrN.При замещении в молекуле аммиака только двух атомов водорода получаются имиды: 2 Na + 2 NH3 = 2 NaNH2 + H2 + 146 кДж
С водой : NaNH2 + H2O = NH3 + NaOH
а при замещении лишь одного — амиды
Слайд 9
Соединения азота
Хлор и бром энергично реагирует с аммиаком
по схеме:
2 NH3 + 3 Г2 = 6 НГ
+ N24 NH3 + 3 F2 = 3 NH4F + NF3 (фтористый азот)
2 NH3 + Cl2 = NH4Cl + NH2Cl (хлорамин)
Слайд 10
Кислородные соединения азота
Гемиоксид азота может быть получен разложением:
NH4NO3
= 2 H2O + N2O + 40 кДж
(NN=O)Выше 500 С гемиоксид азота разлагается :
2 N2O = 2 N2 + O2 + 163 кДж
С кислородом N2O не соединяется
Вдыхание гемиоксида азота в смеси с воздухом вызывает характерное состояние опъянения
Слайд 11
Кислородные соединения азота
Образование монооксида азота из элементов при
обычных условиях не происходит. Лишь примерно с 1200 С
начинает заметно протекать обратимая реакция:N2 + O2 + 180 кДж 2 NO.
В лаборатории его чаще всего получают:
3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
2 HNO2 + 2 HI = 2 NO + I2 + 2 H2O
Слайд 12
Кислородные соединения азота
Хим св-ва NO :
2 NO +
2 SO2 = 2 SO3 + N2
2 NO +
O2 = 2 NO2 + 113 кДж
Слайд 13
Кислородные соединения азота
Диоксид азота:
2 Рb(NO3)2 = 2 PbO
+ 4 NO2 + O2
Взаимодействие NO2 с NO:
NO2 +
NO N2O3 + 42 кДж3 NO2 + H2O = 2 HNO3 + NO
избыток кислорода: 4 NO2 + 2 H2O + O2 = 4 HNO3
2 NO2 + 2 NaOH = NaNO2 + NaNO3 + H2O
Слайд 14
Азотная кислота
Азотную кислоту получают взаимодействием природной селитры с
концентрированной серной кислотой при нагревании:
NaNO3 + H2SO4 = NaHSO4
+ HNO33 NO2 + H2O 2 HNO3 + NO + 70 кДж
Смесь концентрированной HNO3 c концентрированной HCl называют обычно “царской водкой”. Она действует значительно энергичнее, чем каждая из этих кислот в отдельности.
Au + HNO3 + 3 HCl = AuCl3 + NO + 2 H2O
3 Pt + 4 HNO3 + 12 HCl = 3 PtCl4 + 4 NO + 8 H2O.
Отвечающий азотной кислоте ангидрид может быть получен взаимодействием NO2 с озоном:
2 NO2 + O3 = O2 + N2O5 + 250 кДж
Слайд 15
Азотная кислота (конц)
Азотная кислота конц:
С металлами железом (Fe),
хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием
(Ir), натрием (Na) - не взаимодействует по причине образования на их поверхности защитной плёнкиСо всеми остальными металлами при химической реакции выделяется бурый газ (NO2). Например, при химической реакции с медью (Cu): 4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O
Слайд 16
Азотная кислота (разб)
При взаимодействии с щелочно-земельными металлами, а
также цинком (Zn), железом (Fe), она окисляется до аммиака
(NH3) или же до аммиачной селитры (NH4NO3). Например при реакции с магнием (Mg):10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O
Но может также и образовываться закись азота (N2O), например , при реакции с магнием (Mg):
10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 3H2O
С остальными металлами реагирует с образованием оксида азота (NO), например, растворяет серебро (Ag): 2HNO3 разбавл. + Ag = AgNO3 + NO + H2O
Слайд 17
Химия соединений фосфора
Доля около 0,04% от общего числа
атомов земной коры
Он входит в состав некоторых белковых веществ
(в частности, нервной и мозговой тканей), а также костей и зубов
Слайд 18
Химия соединений фосфора
Получение фосфора
1. Са3(РО4)2 + 8 С
= 8 СО + Са3Р2
2. 3 Са3(РО4)2 +
5 Са3Р2 = 24 СаО + 16 Р
Слайд 19
Химия соединений фосфора
Физические свойства
В парах фосфор четырёхатомен
молекула
Р4 имеет структуру правильного тетраэдра
При охлаждении паров фосфора получается
белая форма (очень ядовит)В воде белый фосфор нерастворим, но хорошо растворим в сероуглероде (СS2). Хранят его под водой и по возможности в темноте
При хранении белый фосфор постепенно (очень медленно) переходит в более устойчивую красную модификацию.
Слайд 20
Химия соединений фосфора
Практически красный фосфор получают длительным нагреванием
белого до 280340 С
Слайд 21
Химия соединений фосфора
Химическая активность фосфора значительно выше, чем
у азота. Так, он легко соединяется с кислородом, галогенами,
серой и многими металлами. В последнем случае образуются аналогичные нитридам фосфиды (Mg3P2, Ca3P2 и др.).Белый фосфор значительно более реакционноспособен, чем красный.
Как и в случае азота наиболее характерными валентными состояниями фосфора 3, 0, 3 и 5
Слайд 22
Химия соединений фосфора
Са3Р2 + 6 Н2О = 3
Са(ОН)2 + 2 РН3 (фосфин)
2 Р + 3 Н2
2 РН3 + 12,5 кДжРН3 бесцветный газ с неприятным запахом (гнилой рыбы). Фосфин является очень сильным восстановителем и весьма ядовит.
Слайд 23
Фосфористая кислота
Свободная фосфористая кислота (Н3РО3) представляет собой бесцветные
кристаллы, расплывающиеся на воздухе и легкорастворимые в воде.
Она
является сильным восстановителем.
Слайд 24
Ортофосфорная кислота
Фосфорная кислота представляет собой бесцветные, расплывающиеся на
воздухе кристаллы.
Будучи трёхосновной кислотой средней силы, Н3РО4 способна образовывать
три ряда солей, дигидрофосфаты, гидрофосфаты и фосфаты
Слайд 25
Ортофосфорная кислота
Наличие у фосфорной кислоты заметных признаков амфотерности
выявляется при её взаимодействии с НСlO4. Реакция (в отсутствие
воды) идёт по уравнению:РО(ОН)3 + НСlO4 = [P(OH)4]ClO4
Р2О5 + Н2О = 2 НРО3 (метафосфорная кислота)
Р2О5 + 2 Н2О = 2 Н4Р2О7 (пирофосфорная кислота)
Р2О5 + 3 Н2О = 2 Н3РО4 (ортофосфорная кислота).
3 Р + 5 НNO3 + 2 H2O = 3 H3PO4 + 5 NO.