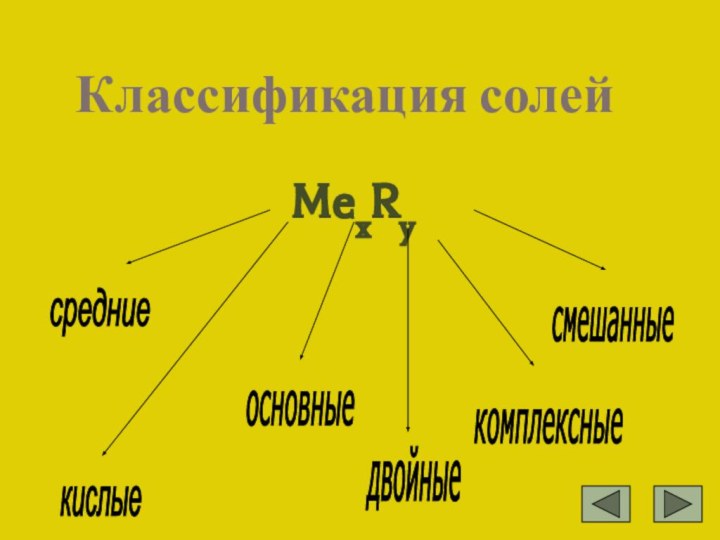
из атомов металла и кислотных остатков (электролиты,образующие при диссоциации катионы
металлов и анионы кислотных остатков)NaCl ⮀ Na+ + Cl-
K3PO4 ⮀ 3K++ PO4 3-
Ca(HCO3)2 ⮀ Ca2+ + 2HCO3 -
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть
















2 моль
1 моль
1 моль
1 моль
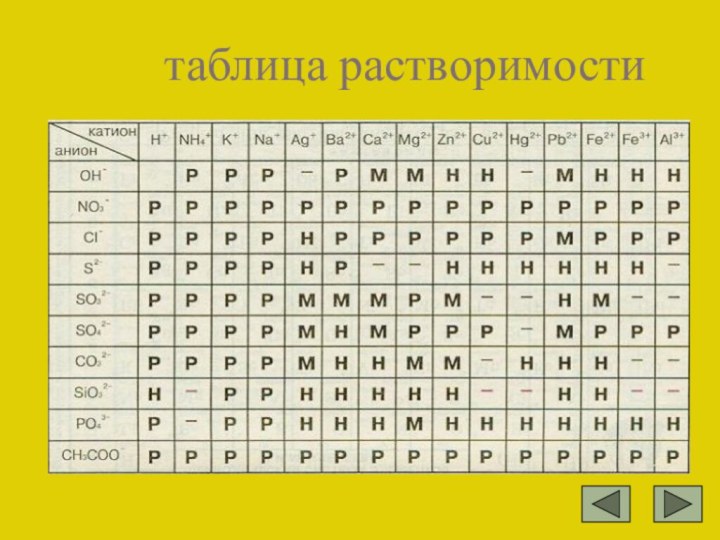
Таблица растворимости солей
6. Взаимодействие основных оксидов
с кислотными оксидами
CaO+SiO2=CaSiO3
7. Взаимодействие металлов
с неметаллами
2K+Cl2=2KCl
8. Взаимодействие металлов с кислотами
Zn+2HCl=ZnCl2+H2?
9. Взаимодействие металлов с солями
Fe+CuSO4=FeSO4+Cu
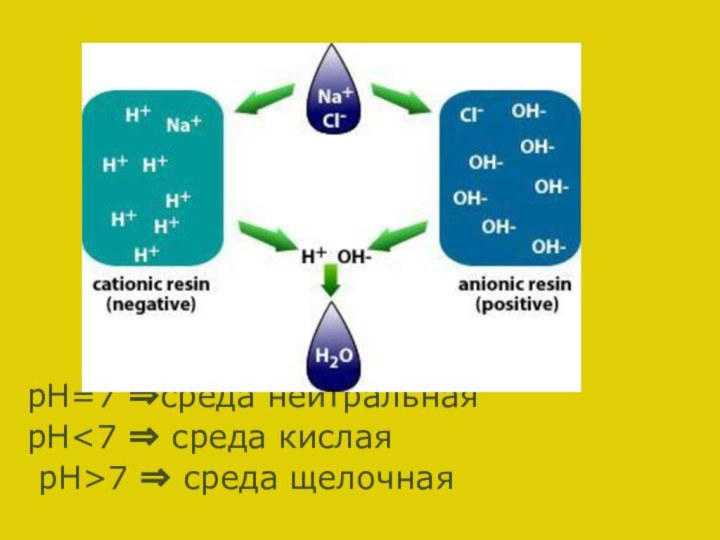
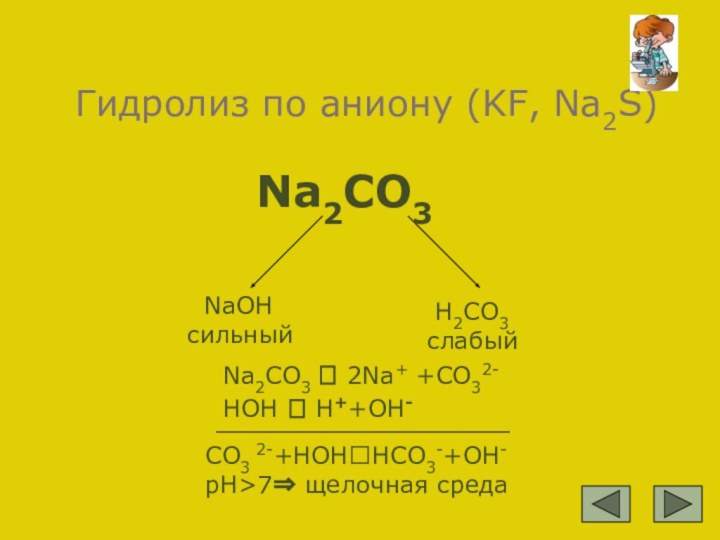
CO3 2-+HOH?HCO3-+OH- pH>7⇒ щелочная среда
HCl сильный
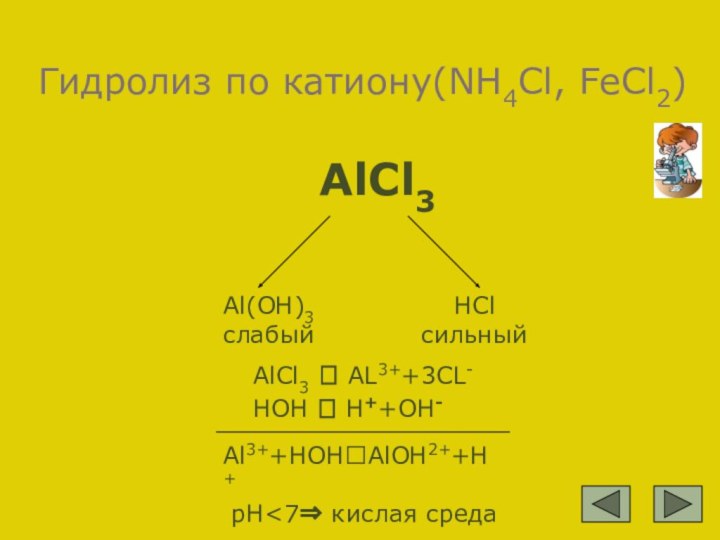
Al3++HOH?AlOH2++H+
рH<7⇒ кислая среда
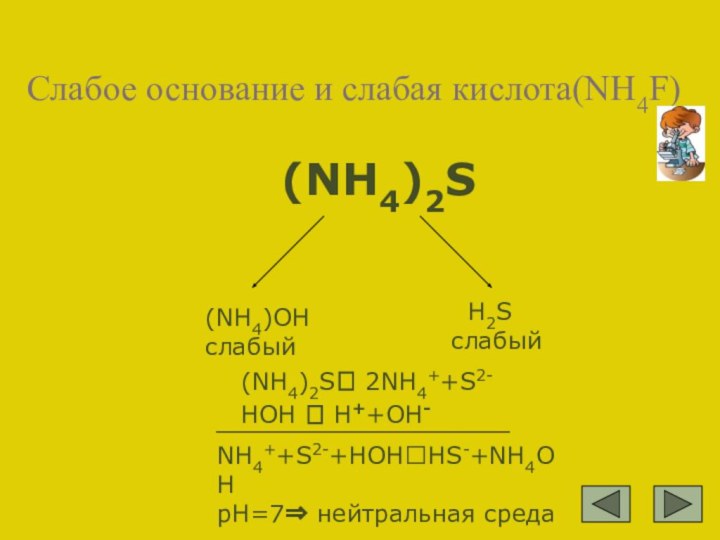
NH4++S2-+HOH?HS-+NH4OH
pH=7⇒ нейтральная среда
(NH4)OH слабый
H2S слабый
(NH4)2S⮀ 2NH4++S2- HOH ⮀ H++OH-
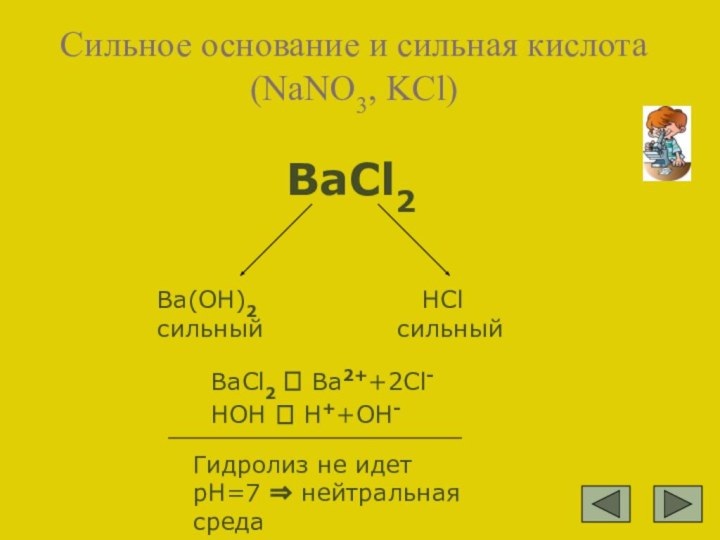
Ba(OH)2 сильный
HCl сильный
BaCl2 ⮀ Ba2++2Cl- HOH ⮀ H++OH-
Гидролиз не идет рН=7 ⇒ нейтральная среда