Слайд 2
Улучшить здоровье детей - задача для школы непосильная.
Целью работы школьного коллектива может быть только
охрана и
сохранение здоровья,
мотивация участников образовательного процесса на здоровый образ жизни.
Слайд 3
Вопросы здоровьесбережения
на уроках химии
Задачи учителя:
Помочь ученику
сохранить свое здоровье
Помочь приобрести знания об основах здорового
образа жизни
Вызвать интерес к самопознанию и самосовершенствованию
Слайд 4
Формы работы
Введение вопросов здоровьесбережения
в содержание урока:
Уроки здоровья «Питание и здоровье», о наркотических
веществах, о табаке и курении; повторно-обобщающие уроки
Частичное введение некоторых вопросов в содержание урока – значение изучаемых в теме веществ для организма человека, правила обращения с веществами
Введение материала в содержание расчетных задач
Факультативные занятия и кружковая работа.
Слайд 5
Задачи на основные понятия и законы химии
Из приведенного
ниже перечня выпишите отдельно названия веществ и названия тел,
соблюдая порядок, в котором они написаны:
ручка, стекло, стакан, олово, карандаш, тарелка, керамика, очки, ртуть, алюминий, тальк.
Составив слово из первых букв веществ, вы узнаете, кто является автором строк «Здоровье – это не все, но все без здоровья ничто»,
Ответ:
Стекло, Олово, Керамика, Ртуть, Алюминий, Тальк
Слайд 6
Задачи на основные понятия и законы химии
Запишите русские
названия химических элементов: Ba, Al, Ni, N, Na.
Из
первых букв названий вы узнаете фрукт, который рекомендуют для профилактики агрессивных проявлений;
Ответ: Банан.
но его лучше не есть натощак, так как это способствуют образованию газов. Оказывается, у замороженного фрукта вкус такой же, как и у ванильного мороженного, он не менее сладок, а калорий и жира в нем значительно меньше.
Слайд 7
Задачи на основные понятия и законы химии
Определить в
каком количестве вещества меди содержится 31• 10²³ атомов.
Ответ вам подскажет суточную потребность организма в меди (в миллиграммах).
Медь участвует в синтезе гемоглобина и
определяет антиоксидантный потенциал
сыворотки крови.
Решение:
n (Cu) = 31• 10²³ / 6,02 • 10²³ = 5 (моль)
Ответ: 5мг
Слайд 8
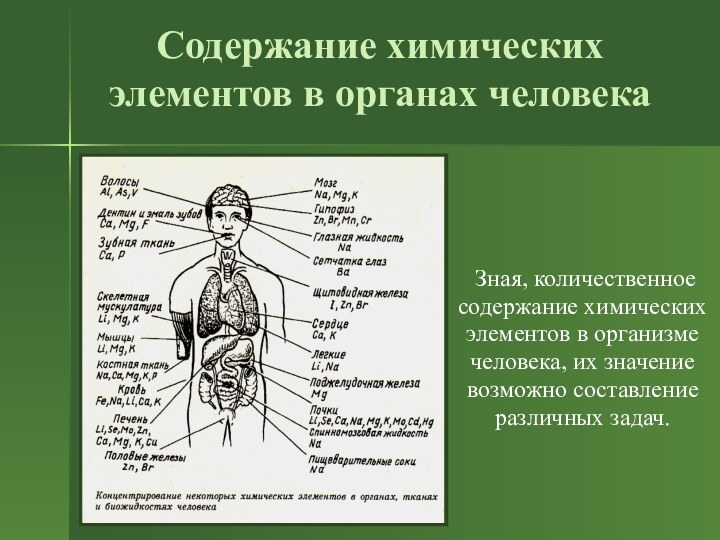
Содержание химических элементов в органах человека
Зная, количественное
содержание химических
элементов в организме
человека, их значение
возможно составление
различных задач.
Слайд 9
Задачи на основные понятия и законы химии
Какое количество
вещества составляет углекислый газ, занимающий объем 134,4 л.
Вычислив, вы узнаете,
сколько минут жизни забирает
одна выкуренная сигарета.
Решение:
Vm (CO2) = 22,4 моль/л
n (CO2) = 134,4 / 22,4 = 6 (моль).
Ответ: Одна выкуренная сигарета
отнимает 6 мин. жизни.
Слайд 10
Задачи на основные понятия и законы химии
Величину шума
в децибелах, ведущего к полной глухоте, если в нем
прибывать несколько часов, вы узнаете, вычислив молярную массу сульфида алюминия.
Нормальный уровень шума составляет величину, равную массе 0,2 моль сульфида алюминия.
Решение: М (Al2S3)= 150 г/ моль
Масса 0,2 моль Al2S3 = 30 г.
Ответ: Величина шума, вызывающая глухоту равна 150 дБ. Нормальный уровень шума – 30 дБ. Громкость звука музыкальных усилителей на дискотеках 110 дБ
Слайд 11
Задачи на основные понятия и законы химии
Вычислите, какое
количество вещества составляет:
а) вода массой 162 грамма,
б) вода
массой 180 граммов.
Полученные ответы подскажут вам, какое количество часов для сна необходимо школьнику среднего звена, чтоб полноценно отдохнуть.
Ответ : продолжительность сна учащихся среднего звена 9-10 часов, старшеклассников не менее 8,5 часов
Слайд 12
Многовариантные задачи
Вычислите какое количество вещества составляет
а) оксид кальция
массой 5,6г
б) оксид калия массой - 4,7 г
в) оксид
серы (IV) массой – 16 г
г) оксид серы (VI) массой- 5,12г
д) оксид цинка – 81г
Ответ вам подскажет, сколько мг витаминов содержится в 100г молока.
Решение :
а) витамина А -0,10 мг б) витамина В1- 0,05 мг
в) витамина В2 – 0,17 мг г ) витамина РР – 0,08 мг
д) витамина С -1,00 мг
Слайд 13
Многовариантные задачи
Вычислив массовые доли химических элементов в молекуле
этилового спирта, вы узнаете, какие заболевания возникают вследствие злоупотребления
алкоголем.
Ответы задачи соответствуют цифрам заболеваний:
0,2 – грипп, насморк; 0, 52 – язвенная болезнь, энурез; 0,13 – слабоумие, галлюцинации; 0,48 – плоскостопие; 0,35 - импотенция
Решение:
M (C2H6O) = 24 + 6 + 16 = 46
ω (С) = 24 / 46 = 0,52
ω (Н) = 6 / 46 = 0,13
ω (О) = 16 / 46 = 0,35
У одноатомных спиртов с увеличением числа атомов углерода в молекуле нарастает их гемолитическое действие (гемолиз - разрушение эритроцитов крови с выделением гемоглобина во внешнюю среду). Спирты – гемолитические яды (как, например, змеиные яды)
Слайд 14
Многовариантные задачи
Составьте уравнения химических реакций, и по количеству
веществ, участвующих в реакции, вы сможете определить продукты, которые
а)
стимулируют обмен веществ в мозге и этим облегчают процесс заучивания
карбонат натрия и соляная кислота:
1-морковь; 2- ананас; 3- горох; 4 – хлеб
б) облегчают восприятие информации и восстанавливают силы
алюминий с раствором серной кислоты:
1- помидор; 2- лимон; 3- грейпфрут; 4 – сосиски
в) нейтрализуют отрицательные эмоции:
железо с хлором:
1- огурец; 2- банан; 3- клубника; 4 - яблоко
Ответ: а) морковь и ананас ( Na2CO3 + 2 HCl →);
б) лимон – облегчает восприятие информации, грейпфрут восстанавливает силы (2Al + 3 H2SO4 →);
в) банан и клубника (2Fe + 3 Cl2 →)
Слайд 15
Многовариантные задачи
Запишите уравнения химических реакции и по числу

электронов, участвующих в процессе окисления, определите, как влияет окружающие
цвета на состояние человека:
1. Окисление алюминия
красный: 1-грусть, 2-спокойствие, 3-активность и раздражительность,
4 – собранность
2. Взаимодействие цинка с соляной кислотой
желтый – 1 рассеянность, 2-активность и оптимизм, 3-пассивность и слабость,
4 – тоска
3. Взаимодействие железа с хлором
зеленый- 1- возбуждение, 2 -агрессивность, 3- спокойствие, 4 – утомление
4. Горение серы
синий – 1- агрессивность, 2- открытость, 3- раздражительность, 4 – нежность
Ответ:
1. Аl – 3e → Al+3 красный: 3 – активность и раздражительность
2. Zn – 2e → Zn+2 желтый: 2 - активность и оптимизм
3. Fe – 3e → Fe+3 зеленый: 3 - спокойствие
4. S – 4e → S+4 синий: 4 - нежность
По мнению ученых, цвет и интерьер комнаты отражают привычки человека, во многом определяя его настроение и самочувствие. Выбирая цветовую гамму комнаты, надо принимать во внимание и ее освещенность. Достаточная освещенность снимает утомление.
Слайд 16
Многовариантные задачи
Запишите уравнения химических реакции:
а) окисления фосфора (V)
б)
горения аммиака в отсутствии катализатора
в) окисления аммиака в присутствии
платинового катализатора
г) разложения нитрата железа(III)
уравняйте,
сложите коэффициенты в уравнениях химических реакции и вы узнаете:
а) в какое время у человека наивысшая работоспособность.
б) в какое время у человека наибольшее утомление
в) в какое время у человека вечерний подъем работоспособности
г) когда необходимо прекращать всякую деятельность
Использование полученных знаний о биологических ритмах при составлении режима дня позволит достичь максимальной работоспособности и повысить сопротивляемость организма к утомлению.
Ответ: а) 4Р + 5О2 = 2 Р2О5 (11часов)
б) 4NH3 + 3O2 = 2N2 + 6H2O (15 часов)
в) 4NH3 + 5O2 = 4NO + 6H2O (19 часов)
г) 4Fe (NO3)3 = 2 Fe2O3 + 12 NO2 + 3 O2 ( 21 час)
Слайд 17
Эвристические задачи
Сульфат бария используют в медицине как
рентгено-
контрастное средство, но в нем недопустима примесь карбоната
бария.
Известны случаи отравления , если в сульфате бария
присутствовала примесь карбоната бария. Объясните причину
отравления и как его избежать.
Решение:
Сульфат бария считается безвредным, так как он не растворим в воде. Но ион бария очень токсичен, Если в сульфате бария присутствует примесь карбоната бария, то, попав в кислотную среду желудка, ион бария будет переходить в раствор:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O
BaCO3 + 2Н+ = Ba²+ + CO2 + H2O
Для избавления от примесей возможно приготовление суспензии не в дистиллированной воде, а в сульфатных растворах, например, в растворе сульфата натрия. То есть, необходимо перевести все примеси соединений бария в нерастворимый сульфат.
Слайд 18
Задачи на растворы
Для рентгеновского исследования желудка
больному дают выпить суспензию сульфата бария. Почему используют именно
сульфат, а не хлорид? Как можно получить сульфат бария, используя серную кислоту? Какую массу 49% серной кислоты нужно взять для получения 100 г сульфата бария?
Решение:
Хлорид бария – растворимая соль, она будет в виде ионов, а сульфат бария в виде суспензии возможно «уловить» рентгеновским аппаратом.
H2SO4 + BaCl2 = 2НCl + Ba SO4↓
n (Ba SO4) = 100/233 = 0,429 (моль)
n (H2SO4) = 0, 429 моль по уравнению.
m (H2SO4 ) = 0,429 • 98 = 42 (г)
m р-ра (H2SO4) = 42 • 0,49 = 20,6 (г)
растворы
Глюкозу в медицине используют в виде растворов различной
концентрации, которые служат источником жидкости и питательного материала, а также способствуют обезвреживанию и выведению ядов из организма.
Рассчитайте, в какой массе раствора глюкозы с массовой долей 5 % следует растворить 120г ее, чтобы получить раствор с массовой долей глюкозы 8 %.
Решение:
Пусть масса 5% раствора – х, тогда
0,05х + 120 = 0,08х + 120 · 0,08
110,4 = 0,03х
х = 3680
необходимо 3680 г 5% раствора.
Слайд 20
Задачи, возникающие из жизнедеятельности школы. ГО и ЧС
В
случае загрязнения атмосферы хлором, можно защититься марлевыми повязками, смоченными
5% раствором питьевой соды и подняться на верхний этаж здания школы.
Объясните с химической точки зрения это явление.
Решение: хлор тяжелее воздуха DвCl2= 71/29 =2,45
гидрокарбонат натрия – соль, образованная слабой кислотой и сильным основанием, идет гидролиз по аниону – среда щелочная, хлор нейтрализуется
Сl2 + 2NaOH = NaCl + NaClO + H2O
В случае загрязнения атмосферы аммиаком, надеть марлевые повязки, смоченные 3% раствором уксусной кислоты и располагаться на первых этажах.
Объясните с химической точки зрения это явление.
Решение: аммиак легче воздуха
Dв NH3 = 17/29 = 0,59
аммиак обладает основными свойствами и нейтрализуется уксусной кислотой:
NH3 + CH3COOH = CH3COONH4
Слайд 21
Правила техники безопасности
Простейшим способом удаления пролившейся
ртути является
обработка загрязненного места
йодной настойкой. Какую массу йодной настойки,
содержащей 5% йода, нужно использовать для
уничтожения 2г ртути.
Решение:
2Hg + I2 = Hg2I2
n(Hg)/2=n(I2)/1
n (Hg) = m (Hg) / M (Hg)
n(I2) = m (I2) / M (I2) = ω (I2) х m (р-ра)/ M (I2)
m (р - ра) = m (Hg) х M (I2) / {2 M (Hg) ω (I2) }
m (р - ра) = 2.254./ {2.201/0,05}= 25,3 (г)
Слайд 22
« Домашние » задачи
Плохой уход
за зубами, особенно несвоевременное удаление остатков пищи, - одна
из причин кариеса.
Почему для зубов особенно опасна углеводная пища
(белый хлеб, печенье, сахар)?
Ответ: многочисленные бактерии, находящиеся во рту, потребляют из пищи сахар. В ходе их жизнедеятельности при разложении углеводов образуется молочная кислота, которая повышает кислотность слюны, что разрушающе действует на эмаль и твердые ткани зубов.
Чем больше во рту сахара, тем вероятнее развитие кариеса!!!
Слайд 23
« Домашние » задачи
При неправильном уходе
за ротовой полостью зубы
становятся очень чувствительны к горячей
и
холодной пище, но эти ощущения проходят, если два
раза в день чистить зубы пастой, содержащей фтор.
Как с химической точки зрения объяснить этот факт?.
Ответ:
Соединения фтора переводят Ca5OH(PO4)3 в CaF2 , а он, в свою очередь, адсорбируется на эмали, предохраняя ее от воздействия кислот, образующихся при разложении пищи. Также фторидные соединения подавляют жизнедеятельность бактерий, эмаль не разрушается и становится не чувствительной к горячей и холодной пище.
Слайд 24
« Домашние » задачи
В составе желудочного
сока содержится соляная кислота. Избыток ее (повышенная кислотность) вызывает
изжогу в организме. Если соляной кислоты ниже нормы, то у человека пониженная кислотность. При «изжоге» в домашних условиях часто принимают питьевую соду.
Запишите уравнения химической реакции. Возможно ли с помощью питьевой соды навсегда избавиться от «изжоги». Почему?
Ответ:
NaHCO3 + HCl = NaCl + CO2 + H2O
C помощью питьевой соды нельзя навсегда избавиться от «изжоги» так как временная нейтрализация кислоты ведет к дальнейшему увеличению ее образования:
CO2 + H2O + Cl¯ → HCl + HCO3¯
Слайд 25
« Домашние » задачи
Перманганат калия –KMnO4
используется в
медицине в виде 5% раствора для смазывания
обожженных мест и как кровоостанавливающее
средство. Определить массу перманганата калия и
воды, необходимых для приготовления 50 г данного раствора.
Более слабые растворы употребляются для полоскания рта и горла как дезинфицирующее средство вследствие его высокой окислительной способности.
Решение:
m(KMnO4) = 50 • 0,05 = 2,5 9 (г).
m(H2O) = 50 – 2,5 = 47,5 (г)
Слайд 26
« Домашние » задачи
Какие вещества, находящиеся
в домашней аптечке, как дезинфицирующие препараты, можно использовать для
получения кислорода.
Запишите уравнения химических реакций и условия их проведения:
Решение:
2KMnO4 = K2MnO4 + MnO2 + O2
2H2O2 = 2H2O + O2
(tº выше 150º или медленное разложение при
комнатной температуре)
Слайд 27
« Домашние » задачи
В домашней
аптечке хранятся такие вещества как перманганат калия, нашатырный спирт,
этиловый спирт. Обсудите возможность взаимодействия между ними. Напишите уравнения возможных реакций, укажите условия, в которых они протекают. Что вы знаете об их использовании, как медицинских препаратов.
Решение:
2KMnO4 + 3С2 Н5ОН = 2MnO2 + С Н3СНО + 2КОН + 2H2O (20-30º) 2KMnO4 + 2(NH3 • H2O) конц. = 2MnO2 + N2 + 2KOH + H2O
Слайд 28
« Домашние » задачи
Используя вещества из
домашней аптечки, ученик попытался провести химические реакции. Какие вещества
ему необходимо взять, и при каких условиях провести химические реакции, если он предполагает получить следующие вещества (все продукты реакции указаны без коэффициентов)
MnO2 + СН3СНО + КОН + H2O
MnO2 + N2 + KOH + H2O
Слайд 29
« Домашние » задачи
Пурген (фенолфталеин) применяют
как слабительное средство. Какую окраску приобретет пурген в растворах
нашатырного
спирта
питьевой соды
этилового спирта.
Ответ мотивируйте.
Ответ:
Раствор аммиака – щелочь, раствор гидрокарбоната натрия имеет щелочную среду, поэтому, фенолфталеин приобретает малиновую окраску:
HCO3- + H2O = H2CO3 + OH-
Слайд 30
Задачи можно:
предложить учащимся как химическую разминку в
начале урока
при закреплении нового материала
как дополнительное задание во время
контрольной работы
как творческое задание по самостоятельному составлению задач
или предложить подобрать к математическим расчетам материал по здоровьесбережению