- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Светоносный элемент
Содержание
- 2. План урокаПаспортные данные фосфораСтанция историческаяСтанция «Аллотропные модификации»Станция геологическаяСтанция химическаяСтанция прикладнаяСтанция здоровьяСтанция контрольная
- 3. Фосфор – химический элемент Паспортные данные фосфораОхарактеризуйте
- 4. Станция историческая В 1669 году
- 5. «Да! Это была собака, огромная, черная как
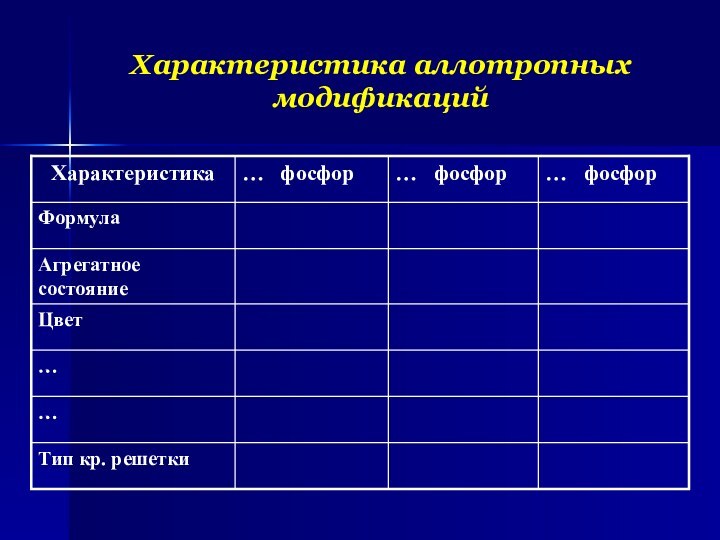
- 6. Характеристика аллотропных модификаций
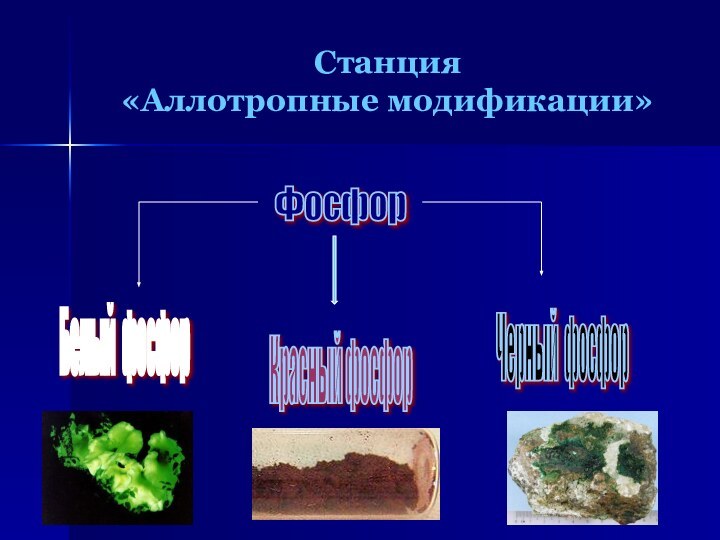
- 7. Станция «Аллотропные модификации»Фосфор Белый фосфор Красный фосфор Черный фосфор
- 8. Белый фосфорНаиболее распространен белый, или желтый, фосфор.
- 9. Красный фосфорАморфный темно-малиновый порошок без запаха. Менее
- 10. Черный фосфорРомбическая модификацияКубическая модификация Имеет
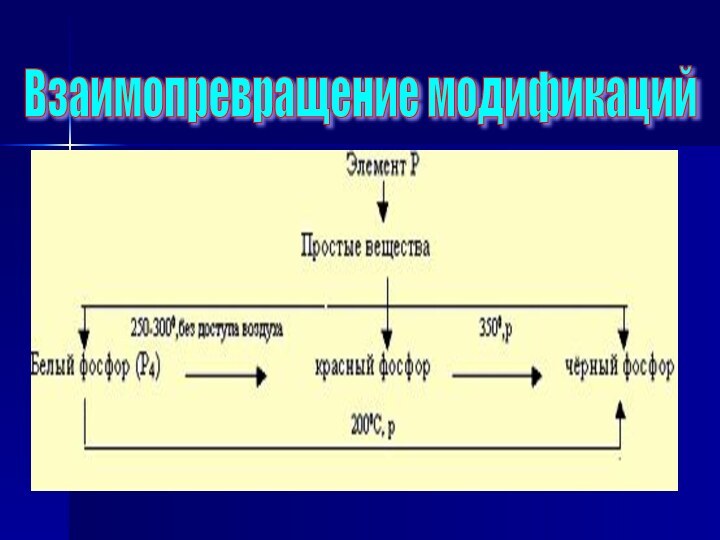
- 11. Взаимопревращение модификаций
- 12. Станция геологическаяФосфор встречается в природе только в
- 13. Станция химическаяВзаимодействие с активными металлами: Mg + P
- 14. Станция прикладнаяБолее половины объема мирового производства фосфора
- 15. Станция здоровьяПо содержанию в организме человека фосфор
- 16. Знаете ли вы, что…пшеница при среднем урожае
- 17. Станция контрольная
- 18. Скачать презентацию
- 19. Похожие презентации















Слайд 2
План урока
Паспортные данные фосфора
Станция историческая
Станция «Аллотропные модификации»
Станция геологическая
Станция
химическая
Слайд 3
Фосфор – химический элемент
Паспортные данные фосфора
Охарактеризуйте фосфор по
положению
в периодической системе химических элементов
Д.И. Менделеева.
Опишите электронное
строение атома фосфора.Назовите возможные степени окисления фосфора.
Напишите формулу его высшего оксида, гидроксида и летучего водородного соединения.
Слайд 4
Станция историческая
В 1669 году немецкий
алхимик Хеннинг Бранд при нагревании смеси белого песка с
выпаренной мочой получил светящееся в темноте вещество, названное сначала «холодным огнем», вторичное название «фосфор» происходит от греческих слов «фос» – свет и «феро» – несу.Слайд 5 «Да! Это была собака, огромная, черная как смоль…
Из ее отверстой пасти вырывалось пламя, глаза метали искры,
по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. «Фосфор», – сказал я».
Слайд 8
Белый фосфор
Наиболее распространен белый, или желтый, фосфор. Белый
фосфор имеет молекулярную решетку, в узлах которой находятся тетраэдрические
молекулы Р4.Это очень реакционноспособное, мягкое воскообразное вещество бледно-желтого цвета, с неприятным чесночным запахом, растворимое в сероуглероде и бензоле,
нерастворимое в воде. Очень ядовит. Воспламеняется при трении, обладает уникальной способностью светиться в темноте за счет медленного окисления.
Температура плавления – 44оС. В лаборатории его хранят под слоем воды. Смертельная доза– 0,1 г.
Слайд 9
Красный фосфор
Аморфный темно-малиновый порошок без запаха. Менее активен,
чем белый фосфор, нерастворим в воде и сероуглероде, не
светится в темноте и не самовоспламеняется, абсолютно безвреден. Температура возгорания – 260оС.
Слайд 10
Черный фосфор
Ромбическая модификация
Кубическая модификация
Имеет атомную
кристаллическую решетку. По внешним признакам черный фосфор напоминает графит,
имеет металлический блеск, обладает электропроводностью и теплопроводностью, довольно твердый. Наименее активный из всех модификаций.
Слайд 12
Станция геологическая
Фосфор встречается в природе только в связанном
состоянии. Массовая доля фосфора в земной коре – около
0,12%.Важнейшие минералы:
Сa3(PO4)2 – фосфорит;
3Сa3(PO4)2∙Ca(OH)2 – гидроксиапатит;
3Сa3(PO4)2∙CaF2 – фторапатит.
В 1806 г. Ф. Велер предложил получение фосфора
из фосфата кальция, песка и угля. Расставьте коэффициенты в уравнении реакции с электронным балансом:
Ca3(PO4)2 + C + SiO2 → P4 + CO + CaSiO3
Слайд 13
Станция химическая
Взаимодействие с активными металлами:
Mg + P →
Взаимодействие
с кислородом:
Р + О2 →
Взаимодействие с бертолетовой солью:
Р +
KClO3 → Р2О5 + KClДопишите уравнения реакций. Какую роль выполняет фосфор в этих реакциях? Составьте электронный баланс к данным реакциям.
Слайд 14
Станция прикладная
Более половины объема мирового производства фосфора перерабатывается
в соединения, используемые
в синтетических моющих средствах.
Соединения фосфора используют
для получения антикоррозионных добавок
к маслам и горючему для автомобилей.Сульфиды фосфора стали необходимы в сражении с ржавчиной в металлургии.
Фосфор используется при производстве спичек.
Фосфор нужен для получения фосфористой бронзы.
Слайд 15
Станция здоровья
По содержанию в организме человека фосфор относится
к макроэлементам
(w(Р) = 0,95%).
Фосфор входит в
состав костной, нервной
и мозговой тканей, крови, молока.Фосфором богаты яйца, мясо, молоко, хлеб.
Почти все важнейшие физиологические процессы, происходящие в организме человека, связаны с превращениями соединений фосфора.
Следите за своим здоровьем!
Слайд 16
Знаете ли вы, что…
пшеница при среднем урожае из
почвы берет в год 72 кг азота и 30
кг фосфора?исследования Луны показали присутствие там фосфора (w(Р) = 0,08%)?
каждый из нас носит в себе 4,5 кг фосфора в виде химических соединений?
свыше 85% содержащегося в организме фосфора приходится на долю костной ткани?
в Амстердаме в 1730 г. 31 г фосфора стоил около 80 золотых рублей?