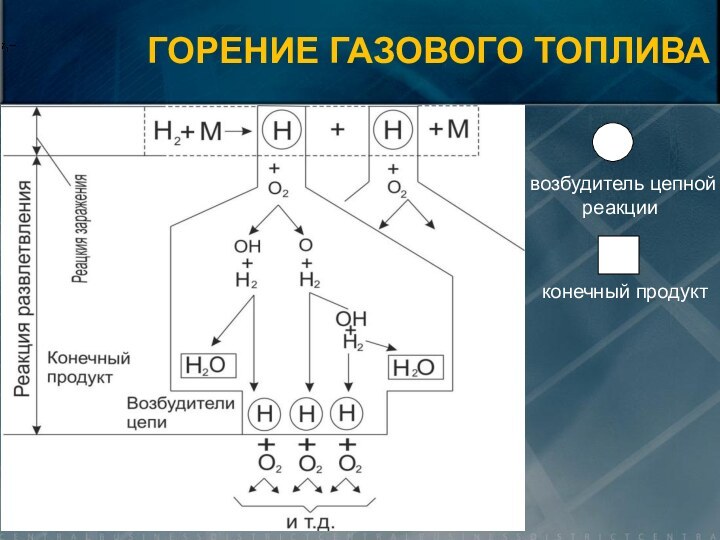
и окислителя характеризующийся:
интенсивным выделении тепла
скачкообразным ростом температуры и концентрации
продуктов горенияснижении концентрации окислителя
преобразованием химической энергии топлива в тепловую энергию, идущую на нагрев продуктов сгорания
ЧТО ТАКОЕ ГОРЕНИЕ?




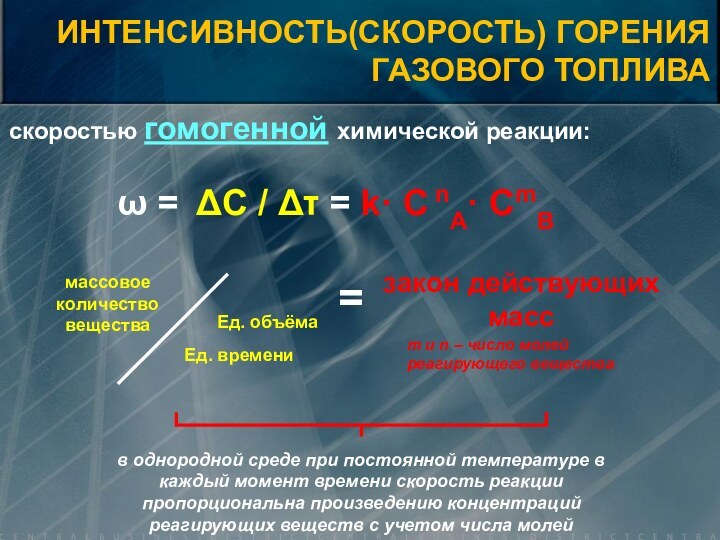




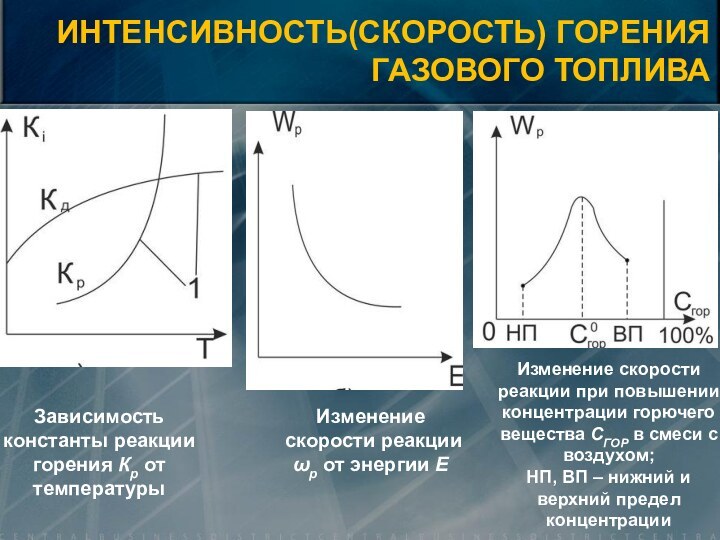

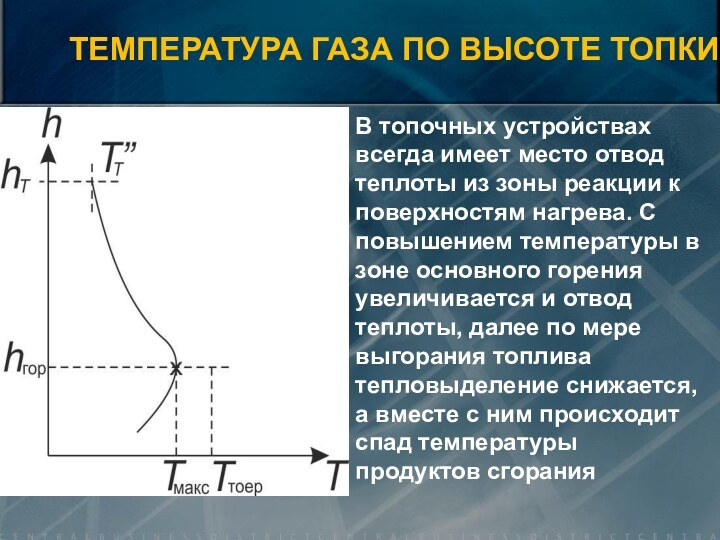

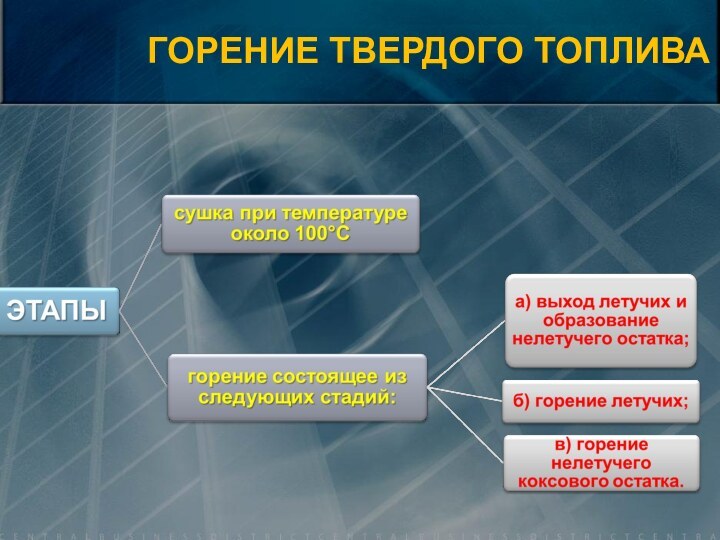














![Элементы теории горения V0=0,889· (CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг] V0 =](/img/tmb/15/1461765/1e743a9682ab68fba755d3f8853bd21d-720x.jpg)
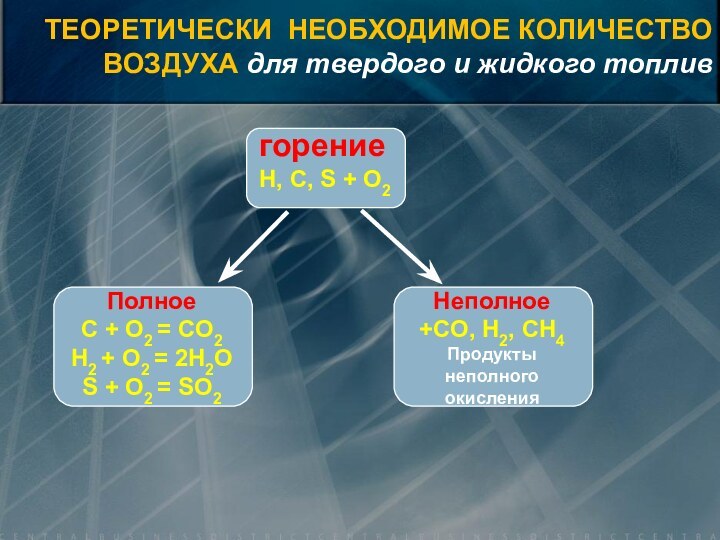
![Элементы теории горения V0=0,889·(CP+0,375·SЛР) + 0,265· HР – 0,033 · OР) [нм3/кг] ТЕОРЕТИЧЕСКИ НЕОБХОДИМОЕ КОЛИЧЕСТВОВОЗДУХА](/img/tmb/15/1461765/0d6500ec331c1357a95199758c9b5f77-720x.jpg)




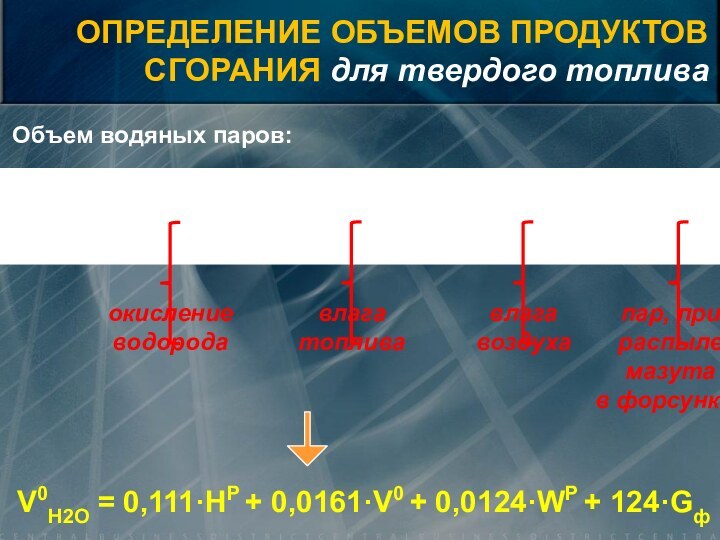
![Элементы теории горения [нм3/кг]Объем трехатомных газов:Объем азота:азотвоздуха азоттопливаОПРЕДЕЛЕНИЕ ОБЪЕМОВ ПРОДУКТОВСГОРАНИЯ для твердого топлива](/img/tmb/15/1461765/0c304fb02b1b1018f6bfc9b082f981f8-720x.jpg)

![Элементы теории горения VRO2 = 0,01·(CO2 + СO + H2S + ∑(n·CnHm)) [нм3/нм3]V0N2 = 0,79·V0](/img/tmb/15/1461765/b6ce74141e7b2c21714d3992622724d9-720x.jpg)



































