- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Свойства основных классов неорганических соединений
Содержание
- 2. ВеществаПростыеНеорганическиеОрганическиеСложныеОксидыСолиГидроксидыКислотыОснованияМолекулы простых веществ состоят из атомов одного элементаМолекулы состоят из 2-х и более атомов
- 3. Классы веществкислотыоснованиясолиоксиды
- 4. ОксидыСолеобразующиеНесолеобразующиеэто сложные вещества, состоящие из двух химических
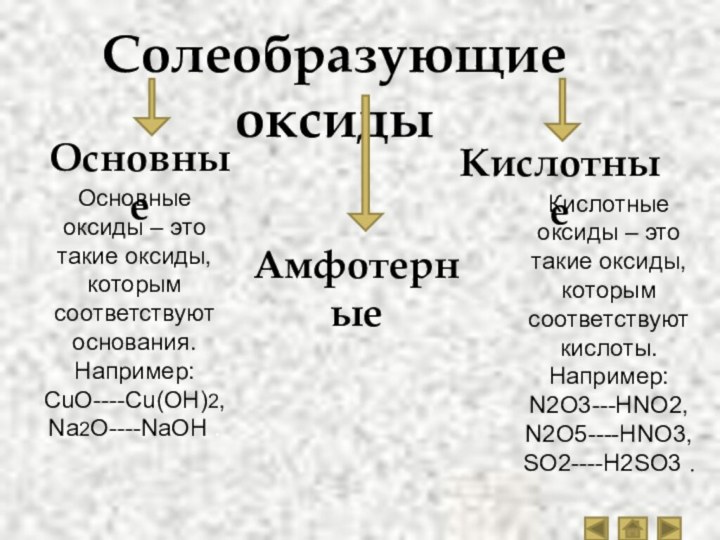
- 5. Солеобразующие оксидыОсновныеАмфотерныеКислотныеОсновные оксиды – это такие оксиды,
- 6. Основный оксид + кислота
- 7. Кислотный оксид + основание
- 8. КислотыЭтот класс соединений широко распространен в природе.
- 9. Кислоты – это сложные вещества, которые состоят из атомов водорода и кислотного остатка.
- 10. Химические свойствакислотКислота + основание
- 11. Кислота + металл
- 12. Основания – это сложные вещества, в состав
- 13. ОснованияВодные растворы щелочей, мылкие на ощупь, разъедают
- 14. Свойства основанийТипичные реакции основанийОснование + оксид неметалла
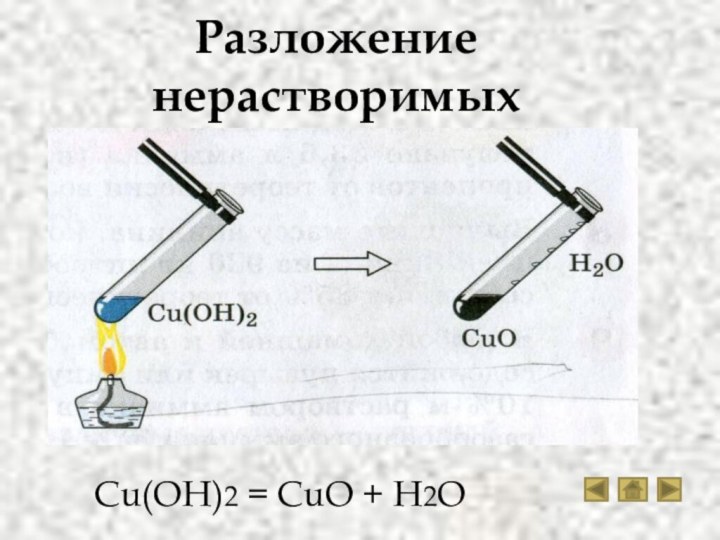
- 15. Разложение нерастворимых основанийCu(OH)2 = CuO + H2O
- 16. СолиСоли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
- 17. Соли имеют самые различные цвета: а -
- 18. Соли кислыесредниеосновныеСредние, или нормальные, соли — это
- 19. Скачать презентацию
- 20. Похожие презентации















Слайд 2
Вещества
Простые
Неорганические
Органические
Сложные
Оксиды
Соли
Гидроксиды
Кислоты
Основания
Молекулы простых веществ состоят из атомов одного элемента
Молекулы
состоят из 2-х и более атомов
Слайд 4
Оксиды
Солеобразующие
Несолеобразующие
это сложные вещества, состоящие из двух химических элементов,
один из которых — кислород со степенью окисления -2.
-
такие оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей.- такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
Слайд 5
Солеобразующие оксиды
Основные
Амфотерные
Кислотные
Основные оксиды – это такие оксиды, которым
соответствуют основания.
Например:
CuO----Cu(OH)2,
Na2O----NaOH .
Кислотные оксиды – это такие оксиды, которым
соответствуют кислоты.Например:
N2O3---HNO2,
N2O5----HNO3,
SO2----H2SO3 .
Слайд 6 Основный оксид + кислота
соль + вода.
(реакция обмена)
CuO + 2HNO3 = Cu(NO3)2
+ H2OОсновный оксид + кислотный оксид соль.
(реакция соединения)
CaO + N2O5 = Ca(NO3)2
Основный оксид + вода щелочь.
(реакция соединения)
K2O + H2O = 2KOH
Основные оксиды взаимодействуют:
Слайд 7 Кислотный оксид + основание
соль + вода.
(реакция обмена)
SO2 + 2NaOH = Na2SO3 +
H2OКислотный оксид + основный оксид соль.
(реакция соединения)
K2O + SO3 = K2SO4
Кислотный оксид + вода кислота.
(реакция соединения)
SO3 + H2O = H2SO4
Кислотные оксиды взаимодействуют:
Слайд 8
Кислоты
Этот класс соединений широко распространен в природе. В
желудке человека содержится сильная бескислородная одноосновная соляная кислота.
В природе
наблюдается многообразие органических кислот .Молочная кислота содержится в кисломолочных продуктах (а), образуется при квашении капусты (б)
Слайд 10
Химические свойства
кислот
Кислота + основание
соль + вода.
(реакция обмена)HСl + NaOH = NaCl + H2O
Кислота + оксид металла соль + вода.
(реакция обмена)
CuO + H2SO4 = CuSO4 + H2O
Кислота + соль новая кислота + новая соль.
(реакция обмена)
H2SO4 + BaCl2 = BaSO4 + 2HCl
Слайд 11 Кислота + металл
соль + водород.
(реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов до водорода. Например,
Zn + 2НСl = ZnCl2 + Н2
2)Должна получиться растворимая соль.
Pb + H2SO4 = PbSO4 + H2
3) Третья реакция характерна для растворов кислот, поэтому нерастворимые кислоты например кремниевая, не вступают в реакции с металлами.
4) Концентрированный раствор H2SO4, раствор НNO3 любой концентрации взаимодействуют с металлами иначе.
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
Взаимодействие кон. НNO3 с медью сопровождается образованием бурого газа – оксида азота (IV)
Слайд 12 Основания – это сложные вещества, в состав которых
входят атомы металла, связанные с одной или несколькими гидросогруппами
(ОН)
Слайд 13
Основания
Водные растворы щелочей, мылкие на ощупь, разъедают кожу,
ткань, изменяют окраску индикаторов. Нерастворимые основания этими свойствами не
обладают.Нерастворимые гидроксиды:
а - гидроксид меди (II); б - гидроксид магния;
в - гидроксид никеля (II); г - гидроксид железа (III); д - гидроксид кобальта (II)
Слайд 14
Свойства оснований
Типичные реакции оснований
Основание + оксид неметалла
соль + вода.
( реакция обмена)2KOH + SO2 = K2SO3 + H2O
Щелочь + соль новое основание + новая соль.
(реакция обмена)
2KOH + CuSO4 = Cu(OH)2 + K2SO4
Слайд 17
Соли имеют самые различные цвета:
а - медный
купорос;
б - дихромат калия;
в - желтая кровяная
соль; г - перманганат калия;
д - хлорид натрия;
е - нитрат никеля (II)
Разнообразие солей
Раковины состоят из карбоната кальция
Малахит
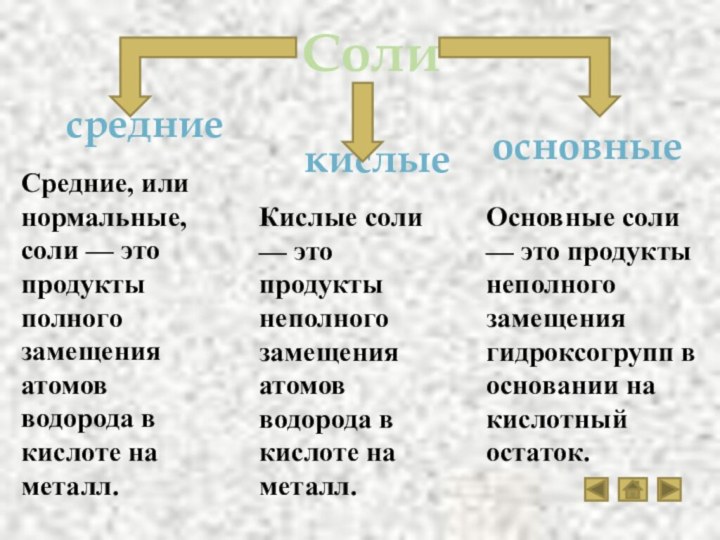
Слайд 18
Соли
кислые
средние
основные
Средние, или нормальные, соли — это продукты
полного замещения атомов водорода в кислоте на металл.
Кислые соли
— это продукты неполного замещения атомов водорода в кислоте на металл.Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.