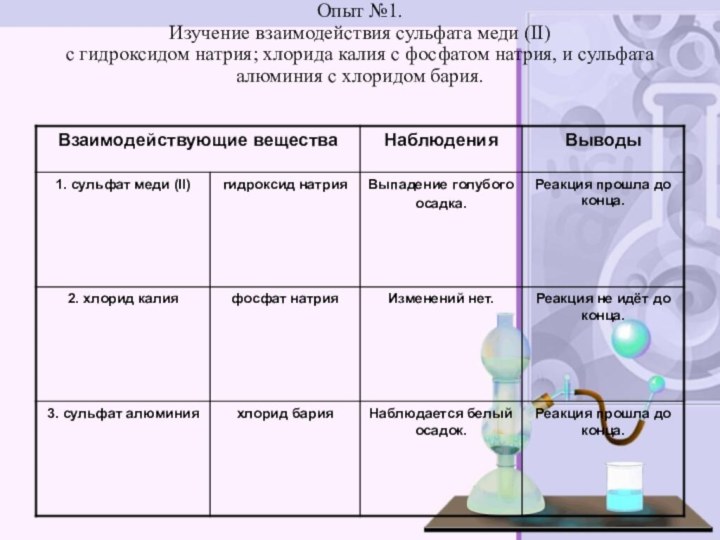
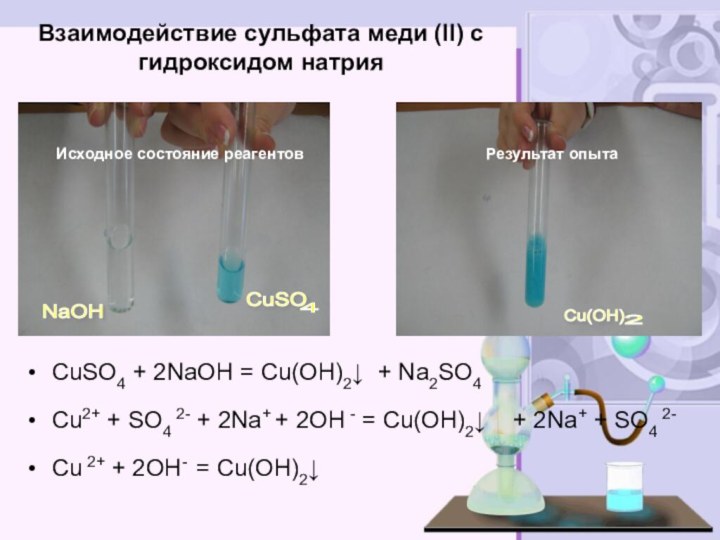
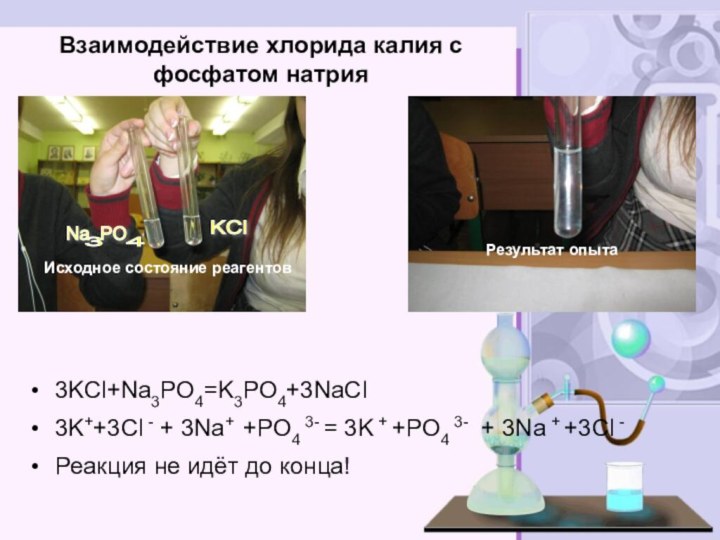
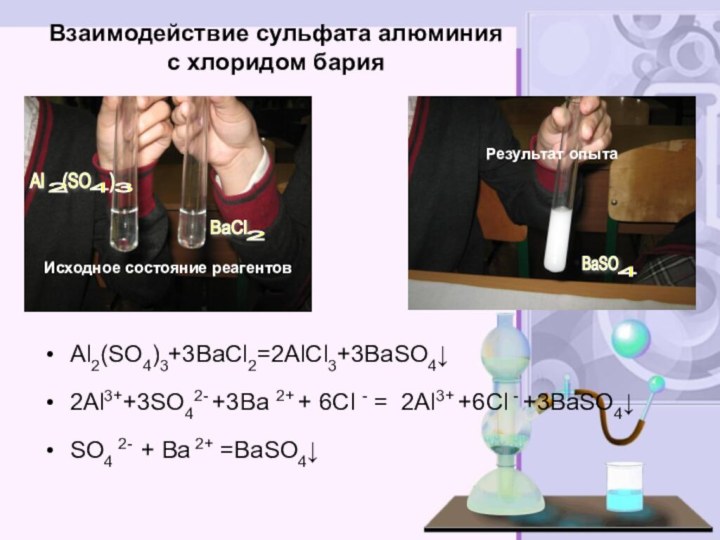
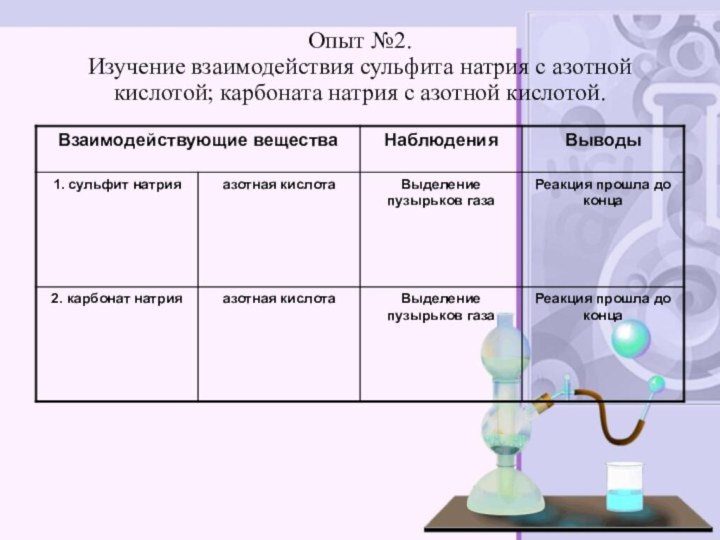
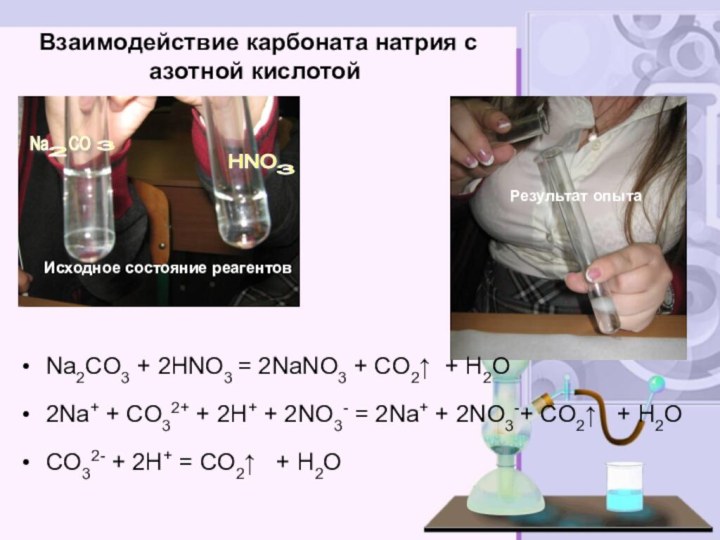
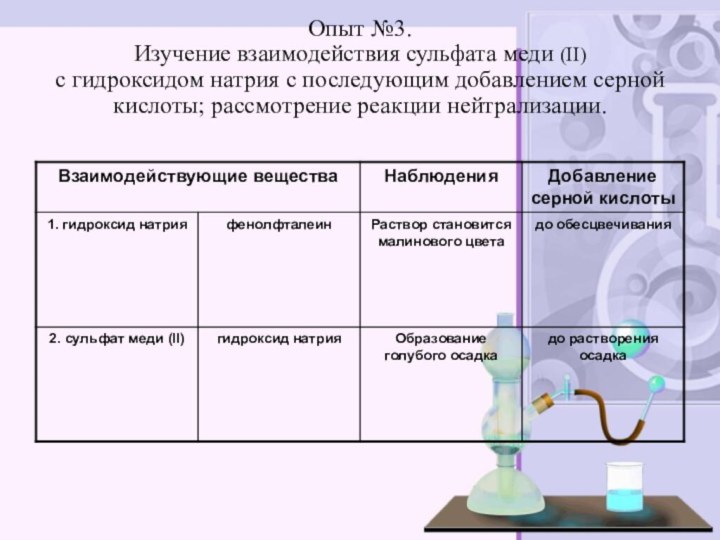
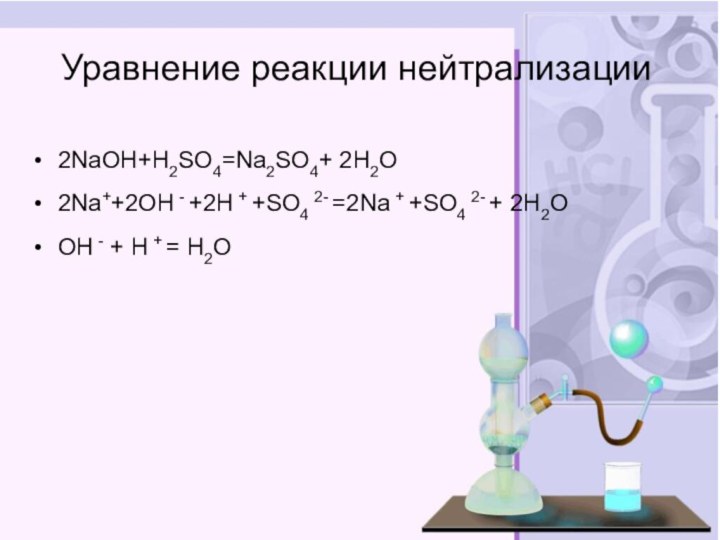
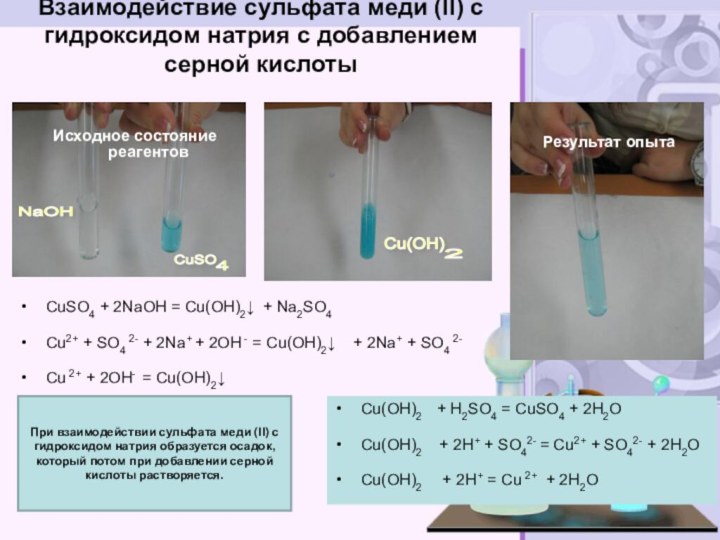
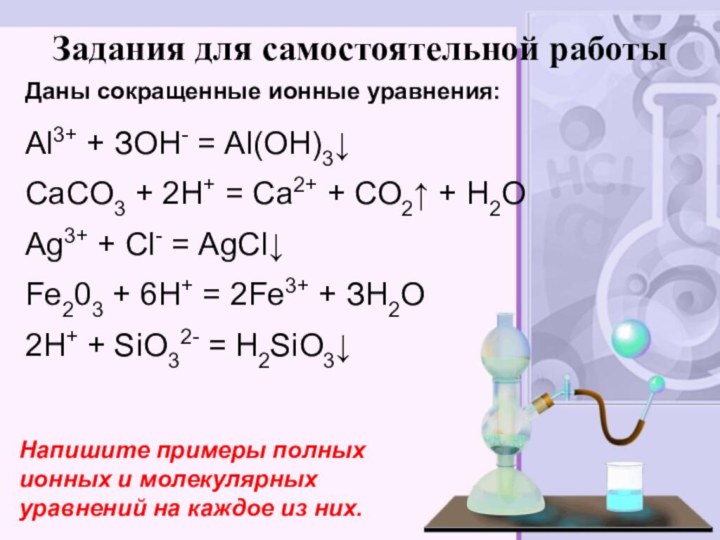
электролитов до конца»
Цель работы:
закрепить знания об
условиях, при которых химические реакции между растворами электролитов идут до конца; продолжить формирование умений работать с растворами веществ.Оборудование и реактивы:
пробирки; растворы сульфата меди (II) (2 %), хлорида калия (2 %), сульфата алюминия (2 %), гидроксида натрия (10%), фосфата натрия (2 %), хлорида бария (2 %), сульфита натрия (2 %), азотной кислоты (1:3), серной кислоты (1:5), фенолфталеина.