- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии 9 класс на тему Кислородсодержащие соединения серы IV
Содержание
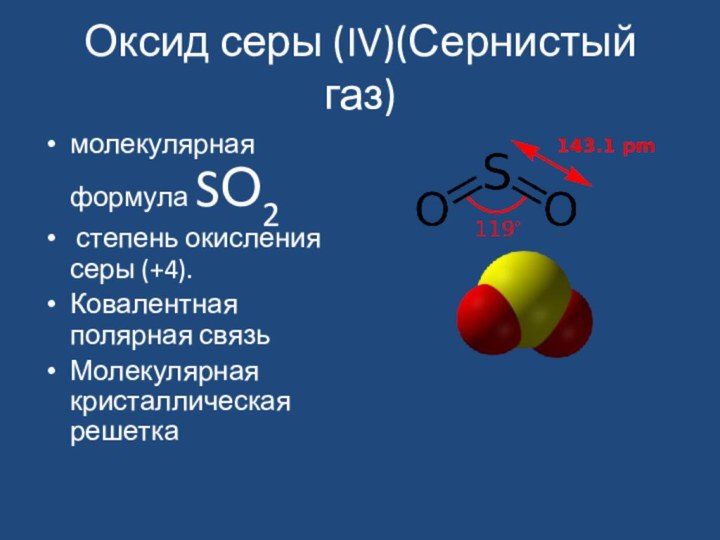
- 2. Оксид серы (IV)(Сернистый газ)молекулярная формула SО2 степень окисления серы (+4). Ковалентная полярная связьМолекулярная кристаллическая решетка
- 3. Нахождение в природе
- 4. Физические свойства. Оксид серы (IV), или
- 5. Химические свойства оксида серы (IV)Относится к
- 6. Окислительно-восстановительные свойства SO2Восстановительные свойства:2SO2+ O2 = 2SO3H2SO3
- 7. Окислительные свойства:В присутствии сильных восстановителей SO2 способен
- 8. Уравнение диссоциации сернистой кислоты. H2SО3 → H+
- 9. Качественная реакция на сульфиты.Взаимодействие соли с сильной
- 10. Получение сернистого газа в промышленности.сжигание серы или
- 11. Получение оксида серы (IV) в лабораторных условияхвоздействием
- 12. Химические свойства оксида серы (IV) 1. Кислотный
- 13. Химические свойства кислот 1. Изменяют окраску индикатора.2.Реагируют
- 14. Применение оксида серы (IV).Большая часть оксида серы
- 15. Физиологическое действие на организм.SO2 очень токсичен. Симптомы
- 16. Воздействие на атмосферу. Из-за образования
- 17. Скачать презентацию
- 18. Похожие презентации
Оксид серы (IV)(Сернистый газ)молекулярная формула SО2 степень окисления серы (+4). Ковалентная полярная связьМолекулярная кристаллическая решетка
















Слайд 4
Физические свойства.
Оксид серы (IV), или сернистый газ,
при н.у. -бесцветный газ с характерным резким запахом (запах
загорающейся спички),более чем в 2 раза тяжелее воздуха,
Растворяется в воде с образованием нестойкой сернистой кислоты, растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте.
Ядовит.
При охлаждении до -10°С сжижается в бесцветную жидкость.
Слайд 5
Химические свойства
оксида серы (IV)
Относится к кислотным оксидам.
Растворяется в воде с образованием сернистой кислоты (при обычных
условиях реакция обратима):SO2 + H2O ↔ H2SO3.
Со щелочами образует сульфиты:
SO2 + 2NaOH → Na2SO3 + H2O.
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr,
2SO2 + O2 → 2SO3 (требуется катализатор V2O5 и температура 450°С),
Слайд 6
Окислительно-восстановительные свойства SO2
Восстановительные свойства:
2SO2+ O2 = 2SO3
H2SO3 +
Br2 + H2O = H2 SO4 + 2HBr
5SO2
+ 2KMnO4 +2H2O = 2H2SO4 +2MnSO4+K2SO4 S+4 - 2е→ S+6 Восстановитель
Слайд 7
Окислительные свойства:
В присутствии сильных восстановителей SO2 способен проявлять
окислительные свойства. Например, для извлечения серы их отходящих газов
металлургической промышленности используют восстановление SO2 оксидом углерода(II):SO2 + 2CO → 2CO2 + S↓.
Или для получения фосфорноватистой кислоты:
PH3 + SO2 → H(PH2O2) + S↓
2H2S-2 + S +4O2 → 2H2O + 3S 0
S+4 +4е→ S0 Окислитель
S-2 -2е→ S0 Восстановитель
Слайд 8
Уравнение диссоциации сернистой кислоты.
H2SО3 → H+ +
HSО3 -
HSО3 - ↔ H+ + SО3
2- Это кислота средний силы, существует только в водных растворах.
Она дает 2 типа солей:
HSО3 - SО3 2-
гидросульфиты сульфиты
Слайд 9
Качественная реакция на сульфиты.
Взаимодействие соли с сильной кислотой,
при этом выделяется газ с резким запахом
Na2SO3+H2SO4=Na2SO4+S02↑+H2O
2NaHSO3+H2SO4=Na2SO4+2SO2↑+2H2O
2HSO3-+2H+=2SO2↑+2H2O
Слайд 10
Получение сернистого газа в промышленности.
сжигание серы или обжиг
сульфидов, в основном — пирита:
4FeS2+ 11O2 = 2Fe2O3 + 8SO2
ZnS
+ O2 = ZnO + SO2
Слайд 11
Получение оксида серы (IV) в лабораторных условиях
воздействием сильных
кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота- H2SO3
сразу разлагается на SO2 и H2O:Na2SO3 + H2SO4 = Na2SO4 + H2SO3
Также действием концентрированной серной кислоты на малоактивные металлы при нагревании
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Слайд 12
Химические свойства оксида серы (IV)
1. Кислотный оксид
+Вода= Кислота
SO2 + H2O = H2SO3
2. Кислотный
оксид + Щелочь = Соль + Н2О SO2 + 2KOH = K2SO3 + H2O
SO2 + 2OH - = SO3 2- + H2O
3. Основной оксид + Кислотный оксид = Соль
CaO + SO2 = CaSO3
Слайд 13
Химические свойства кислот
1. Изменяют окраску индикатора.
2.Реагируют с металлами
в ряду активности до H2 (искл. HNO3 –азотная кислота)
Ме
+ КИСЛОТА =СОЛЬ + H2↑ (р. замещения)3. С основными (амфотерными) оксидами
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
5. Реагируют с солями слабых, летучих кислот - если образуется соль, выпадающая в осадок или выделяется газ: ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании
( искл. H2SO4 ; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Слайд 14
Применение оксида серы (IV).
Большая часть оксида серы (IV)
используется для производства серной кислоты. Используется также в качестве
консерванта (пищевая добавка Е220). Так как этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Оксид серы (IV) используется для отбеливания соломы, шелка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях. Оксид серы (IV) применяется также для получения различных солей сернистой кислоты.
Слайд 15
Физиологическое действие на организм.
SO2 очень токсичен. Симптомы при
отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в
горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отек легких.При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу береза и дуб, наименее — роза, сосна и ель.
Слайд 16
Воздействие
на атмосферу.
Из-за образования в больших количествах в
качестве отходов диоксид серы является одним из основных газов,
загрязняющих атмосферу.Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие ее в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже.





























