Слайд 3
Цели урока:
- рассмотреть распространение воды в природе;
- изучить состав молекулы воды, её свойства- физические и
химические, особенности, значение воды для живых организмов;
- рассмотреть некоторые экологические проблемы, связанные с загрязнением воды.
Тема урока: «Вода в природе. Состав, свойства и применение воды.»
Слайд 4
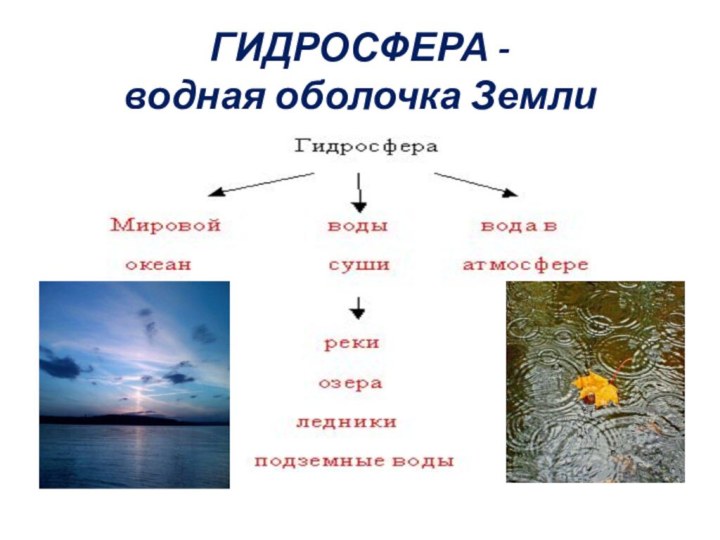
1. Распространение воды
Распространение воды в природе:
71% -
вода 29% - суша
Почти ¾
поверхности земного шара покрыты водой, образующей океаны, моря, реки и озёра. Много воды находится в газообразном состоянии в виде паров в атмосфере, в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах.
Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, а морская вода содержит больше всего примесей.
Слайд 5
ГИДРОСФЕРА -
водная оболочка Земли
Слайд 6
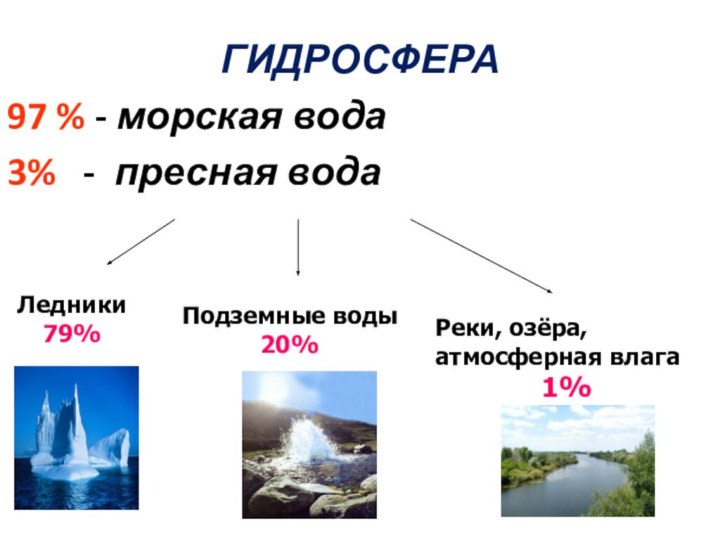
ГИДРОСФЕРА
97 % - морская вода
3% - пресная
вода
Ледники
79%
Подземные воды 20%
Реки, озёра,
атмосферная влага
1%
Слайд 7
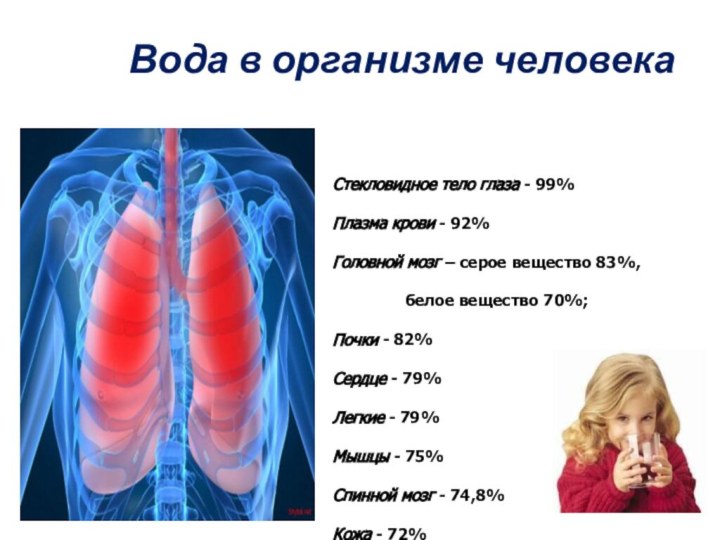
Вода в организме человека
Стекловидное тело глаза - 99%
Плазма
крови - 92%
Головной мозг – серое вещество 83%,
белое
вещество 70%;
Почки - 82%
Сердце - 79%
Легкие - 79%
Мышцы - 75%
Спинной мозг - 74,8%
Кожа - 72%
Печень -70%
Скелет - 46%
Зубная эмаль - 0,2%
Слайд 8
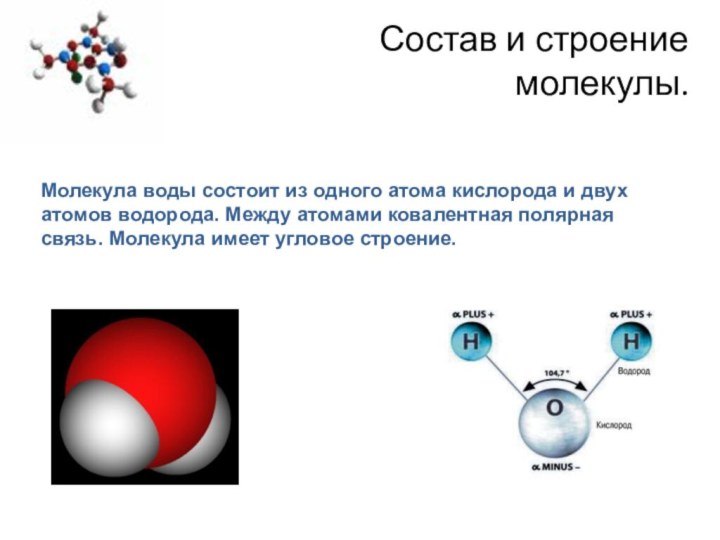
Состав и строение
молекулы.
Молекула воды состоит из одного
атома кислорода и двух атомов водорода. Между атомами ковалентная
полярная связь. Молекула имеет угловое строение.
Слайд 9
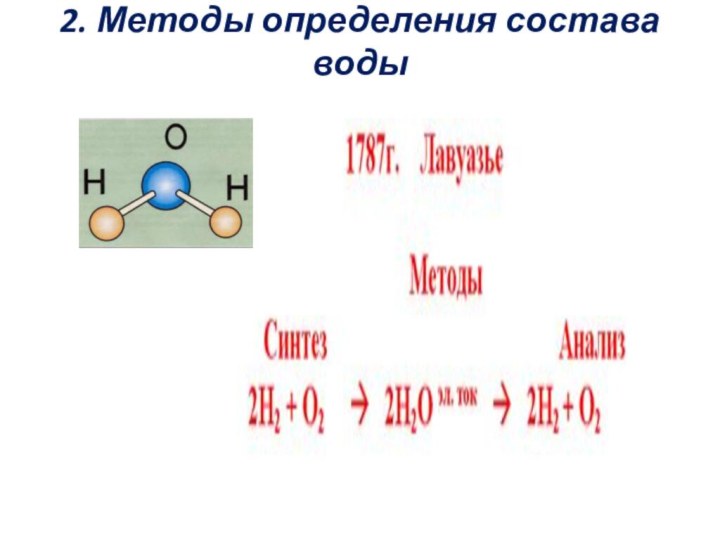
2. Методы определения состава воды
Слайд 10
Методы определения состава вещества.
Анализ (от греческого «анализис» -
разложение) - метод определения состава вещества путем разложения на
более простые.
Синтез (от греческого «синтезис» - соединение) – метод определения состава вещества путем получения из более простых.
Слайд 11
Состав молекулы воды
Н2О
- молекулярная формула
Мr (H20) - ?
Задача. Вычислите массовые доли элементов в воде.
W (Н) = ? %
W(О) = ? %
Слайд 12
Жидкой водой наполнен Мировой океан, поверхностные воды суши
и подземные воды
Твердый лед можно увидеть и в виде
снежинок, и в виде инея
Водяной пар входит в состав атмосферы
3. Физические свойства воды
Вода – жидкость, без цвета, вкуса и запаха. При 0 С переходит в твёрдое состояние (лёд), при 100 С кипит и переходит в газообразное состояние ( водяной пар).
Вода – единственное вещество, которое встречается на Земле во всех трех агрегатных состояниях.
Слайд 13
Физические свойства.
Максимальная плотность при t = 4 0
С равна 1 кг\см3 ,
Вода обладает очень большой
теплоемкостью, поэтому она медленно нагревается и медленно остывает.
Лед имеет меньшую плотность чем вода и поэтому всплывает на ее поверхность.
Структура льда
Слайд 14
Особенности воды
Первая особенность:
замерзая, вода расширяется на 9% по отношению к прежнему
объёму. Поэтому лёд всегда легче незамёрзшей воды и всплывает вверх. Под такой «шубой» даже зимой в Арктике морским животным не очень холодно.
Слайд 15
Вторая особенность:
у воды очень высокая удельная
теплота парообразования. Если бы у воды не было этого
свойства, многие озёра и реки летом быстро бы пересохли до дна, и вся жизнь в них погибла.
Слайд 16
Третья особенность:
высокая теплоёмкость. У воды
она в 10 раз больше, чем у железа. Из-за
исключительной способности воды поглощать тепло, температура при её нагревании и охлаждении изменяется незначительно, поэтому морские обитателям никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение.
Слайд 17
4. Химические свойства воды
1.
Взаимодействует с активными и менее активными металлами
2Na
+ 2Н2О = 2NaOH + H2
гидроксид натрия
Zn+ Н2О t° C Zn O + H2
оксид цинка
Слайд 18
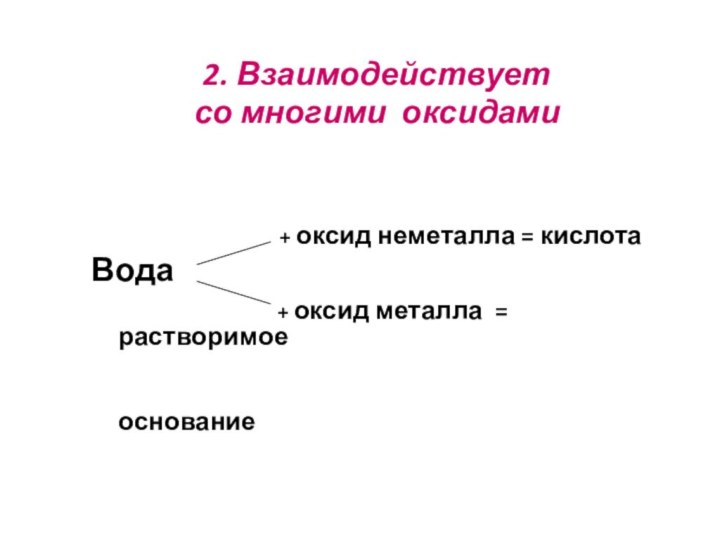
2. Взаимодействует
со многими оксидами
+ оксид неметалла = кислота
Вода
+ оксид металла = растворимое
основание
Слайд 19
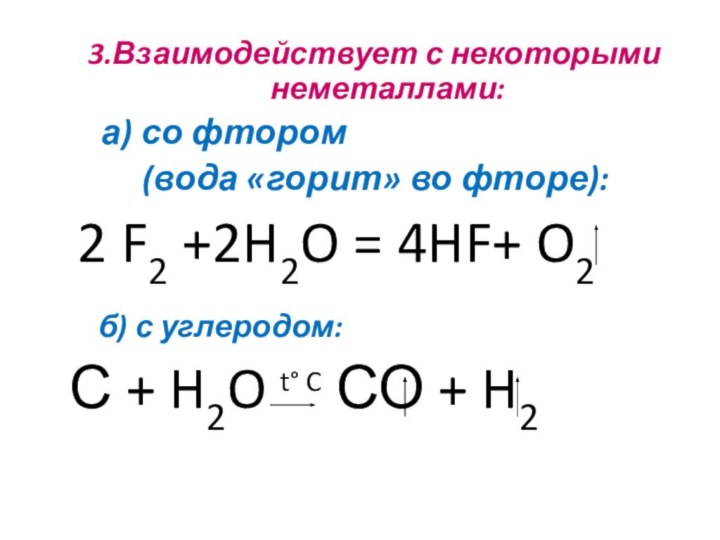
3.Взаимодействует с некоторыми неметаллами:
а) со
фтором
(вода «горит» во
фторе):
2 F2 +2H2O = 4HF+ O2
б) с углеродом:
С + H2O t° C СО + H2
Слайд 20
4. При t= 2000°C или при
пропускании электрического тока вода разлагается на простые вещества –
кислород и водород
2 Н2О 2 Н2 + О2
4.Реакция разложения воды:
эл. ток
Слайд 21
5. Фотосинтез
6СО2 + 6Н2О ? С6Н12О6 + 6О2?
углекислый газ
вода глюкоза кислород
Слайд 22
ЗАДАЧА
Определите массу глюкозы, которая образуется в
процессе фотосинтеза, если растение поглотит 132 г оксида углерода
(IV)
Слайд 23
5. Круговорот воды в природе
Запасы
воды остаются неизменными в течение миллиардов лет, т.к. вода
совершает постоянный круговорот.
Подземные
воды
Испарение
воды
Испарение
воды
конденсация
Слайд 24
Загрязнение мирового океана нефтью
Слайд 25
Трудно представить себе область человеческой деятельности, где не
применялась бы вода
Гидроэлектростанции
Сельское хозяйство
Машиностроение
Строительство
В
быту
Слайд 26
Применение воды.
Приготовление растворов
В медицине
В пищевой промышленности
В строительстве
В сельском
хозяйстве
2. Получение водорода
3. В паровых турбинах
4. Получение синтез газа
5.
В системах охлаждения
6. Для получения оснований
7. Для получения кислот
8. Для получения органических веществ
9. Экологически чистое топливо
10. В быту для стирки, приготовления пищи…
Слайд 27
Это интересно…
…если бы всю воду Земли распределить равномерным
слоем по ее поверхности, то образовался бы Мировой океан
глубиной 4 км.
…в XVI веке королева Англии Елизавета I объявила премию за изобретение дешевого способа опреснение морской воды. Премия пока еще ни кому не вручена. В настоящее время для получения из морской воды 1 км3 пресной воды требуется 7 млн т условного топлива или 2,8 т ядерного горючего.
Слайд 28
Это интересно…
Монокристаллы льда
Слайд 29
Выводы:
Вода – самое распространенное вещество на Земле, основа
всего живого.
Физические свойства воды уникальны, обладают аномальными особенностями.
Вода является
одним из самых химически активных, реакционноспособных веществ.
Вода совершает постоянный круговорот.
Вода находит разнообразные области применения, поэтому в каждой стране должны соблюдаться меры по охране и рациональному использованию водных ресурсов.
Слайд 30
Домашнее задание
Параграф 18, упр.4,5. Решить задачи использованные
в презентации
Творческое задание:
Сделать подборку стихов о воде