Слайд 3
1
При повышении давления равновесие сместится в сторону продуктов
реакции в случае системы:
А. H2 + Br2 ↔ 2HBr; Б. PCl5(г) ↔ PCl3(г) + Cl2;
В. C + CO2 ↔ 2CO;
Г. CO + Cl2 ↔ COCl2(г).
Правило. При увеличении давления равновесие смещается в сторону уменьшения объема газообразных веществ и наоборот.
Слайд 4
2
Кислотную среду имеет раствор соли, формула которой:
А. KCl;
Б. ZnSO4;
В. Na2CO3;
Г. NaNO3.
Ответ подтвердите
уравнением реакции.
Слайд 5
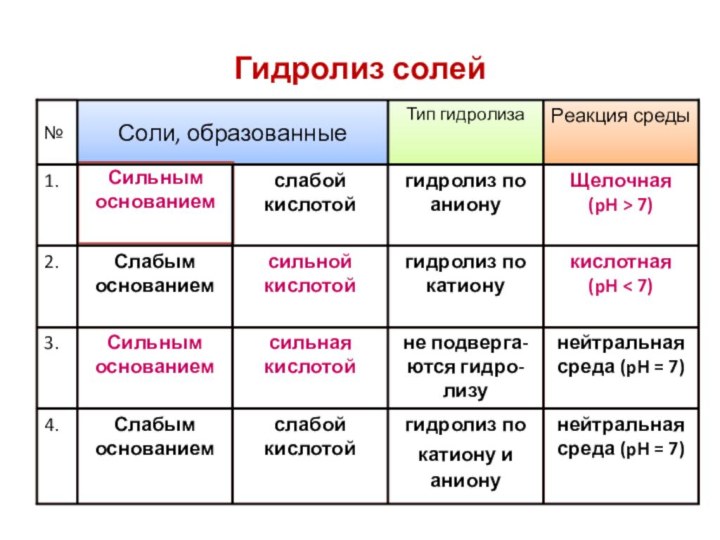
Гидролиз солей
4.
3.
2.
1.
№
Реакция среды
Тип гидролиза
Соли, образованные
нейтральная среда (pH =
7)
гидролиз по
катиону и
аниону
слабой кислотой
Слабым основанием
нейтральная среда (pH = 7)
не
подверга-ются гидро-лизу
сильная кислотой
Сильным основанием
кислотная
(pH < 7)
гидролиз по катиону
сильной кислотой
Слабым основанием
Щелочная
(pH > 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
Слайд 6
3
Формулы группы ионов, которые могут одновременно существовать в
растворе:
А. SO32-, K+, SO42-, H+;
Б. K+, Fe2+, OH-, SO42-;
В. Al3+,
Na+, OH-, Cl-;
Г. K+, Ba2+, OH-, NO3-.
Слайд 7
4
Характеристика реакции, уравнение которой 4Fe +6H2O +3O2 =
4Fe(OH)3
А. Соединения, ОВР, обратимая.
Б. Замещения, ОВР, необратимая.
В. Соединения,
ОВР, необратимая.
Г. Обмена, не ОВР, необратимая.
Слайд 8
5
Краткое ионное уравнение
Ba2+ + SO42- = BaSO4
отображает взаимодействие серной кислоты и вещества:
А. Бария.
Б. Гидроксида
бария.
В. Нитрата бария.
Г. Оксида бария.
Слайд 9
6
Какая масса угля вступает в реакцию, термохимическое уравнение
которой С + О2 = СО2 +402кДж, если при
этом выделяется 1608 кДж теплоты?
Слайд 10
7
Факторы, позволяющие сместить химическое равновесие реакции, уравнение которой
СаО + СО2 = СаСО3 + Q,
в сторону
образования продукта реакции:
А. Повышение температуры и давления.
Б. Понижение температуры и давления.
В. Понижение температуры и повышение давления.
Г. Повышение температуры и понижение давления.
Слайд 11
8
Щелочную среду имеет водный раствор соли, формула которой:
А. AlCl3.
Б. KNO3.
В. K2CO3.
Г. FeCl3.
Слайд 12
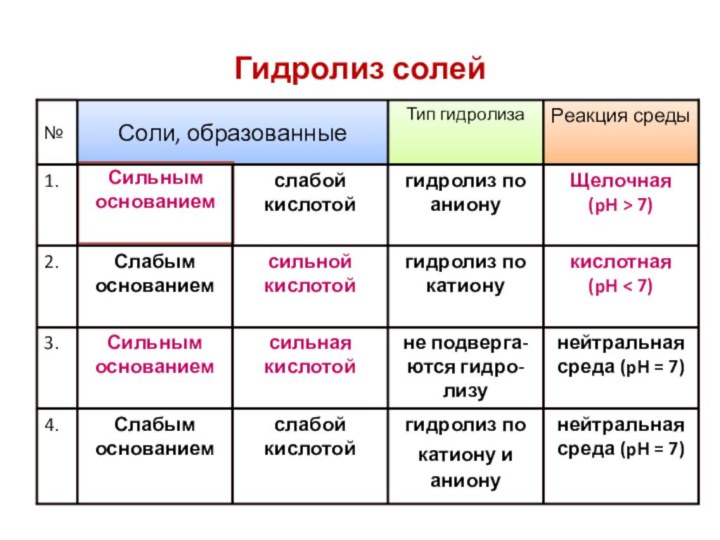
Гидролиз солей
4.
3.
2.
1.
№
Реакция среды
Тип гидролиза
Соли, образованные
нейтральная среда (pH =
7)
гидролиз по
катиону и
аниону
слабой кислотой
Слабым основанием
нейтральная среда (pH = 7)
не
подверга-ются гидро-лизу
сильная кислотой
Сильным основанием
кислотная
(pH < 7)
гидролиз по катиону
сильной кислотой
Слабым основанием
Щелочная
(pH > 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
Слайд 13
9
Установите соответствие. Левая часть уравнения реакции в молекулярном
виде:
Fe + 2HCl =
2. FeO + 2HCl =
3. Fe(OH)2 + 2HCl =
4. Fe(OH)3 + 3HCl =
Правая часть краткого ионного уравнения:
А. = Fe3+ + 3H2O.
Б. =2Fe3+ + 3H2O.
В. = Fe2+ + H2O.
Г. =Fe2+ + 2H2O.
Д. = Fe2+ + H2 .
Слайд 14
10
Составьте уравнения реакции взаимодействия магния с соляной кислотой.
Дайте полную характеристику данной реакции по всем изученным признакам.
Слайд 15
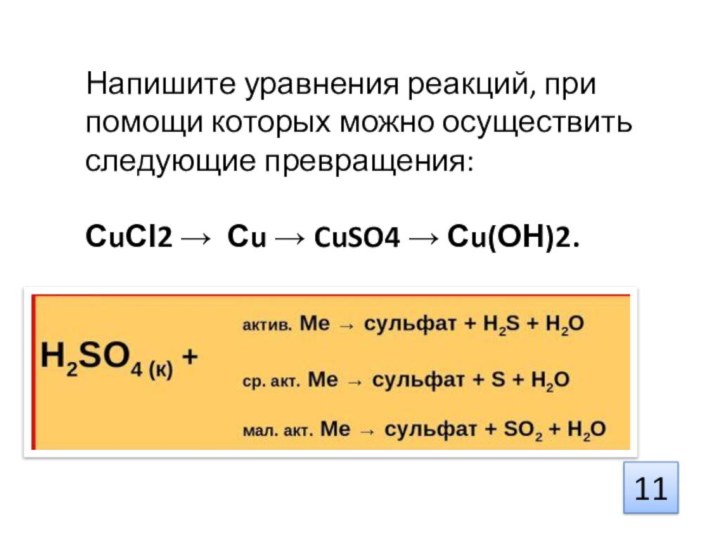
11
Напишите уравнения реакций, при помощи которых можно осуществить
следующие превращения:
СuСІ2 → Сu → CuSO4 → Сu(ОН)2.
Слайд 16
12
С наименьшей скоростью при комнатной температуре протекает реакция
между:
А. Fe и H2SO4(р-р);
Б. AgNO3(р-р) и NaCl(р-р);
В. Cu и O2;
Г. C2H5OH и Na.
Слайд 17
13
К окислительно-восстановительным реакциям
не относится:
А. CH4 + 2O2 → CO2 + 2H2O;
Б. K2O +
H2O = 2KOH;
В. C2H2 + 2Br2 → C2H2Br2;
Г. 2KMnO4 = K2MnO4 + MnO2 + O2.
Слайд 18
14
Сумма коэффициентов в сокращенном ионном уравнении между хлоридом
железа (III) и гидроксидом калия равна:
А. 6;
Б. 5;
В. 4;
Г. 3.
Слайд 19
15
К химическим процессам не относится:
А. Крекинг углеводородов;
Б. Ржавление железа;
В. Плавление льда;
Г. Образование
накипи.
Слайд 20
16
Химическое равновесие в системе CH4 + H2O(r) ↔ 3H2 + CO – Q
смещается в сторону продуктов реакции
при:
А. Повышении давления;
Б. Повышении температуры;
В. Понижении температуры;
Г. Использовании катализатора.
Слайд 21
17
Неверным является утверждение, что при протекании химической реакции:
А. Сохраняется
суммарная масса веществ;
Б. Сохраняются молекулы веществ;
В. Сохраняются атомы веществ;
Г. Сохраняется суммарная энергия.
Слайд 22
18
К окислительно-восстановительным относится реакция, уравнение которой:
А. C2H4 + H2 = C2H6;
Б. CaO
+ H2O = Ca(OH)2;
В. NaCl + AgNO3 = AgCl↓ + NaNO3;
Г. CH3OH + HCl = CH3Cl + H2O.