Содержание
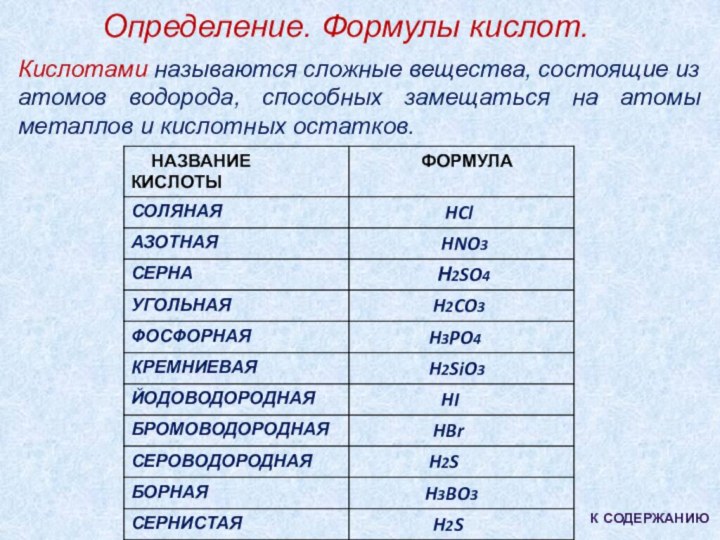
1). Определение. Формулы кислот.
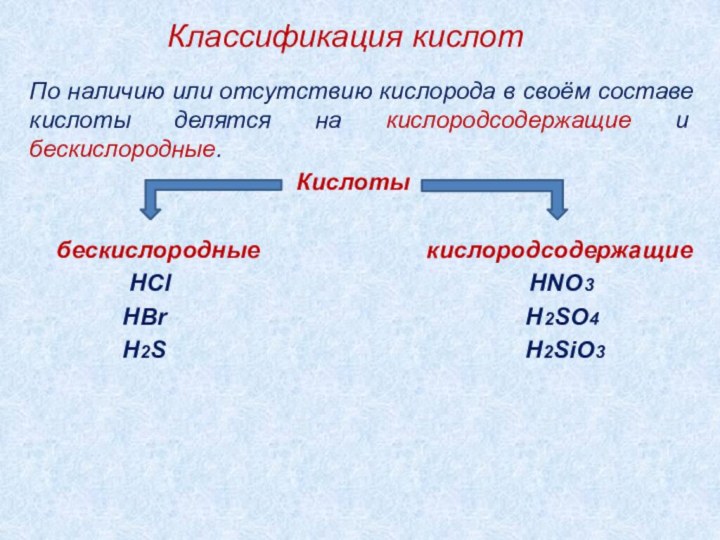
2). Классификация кислот.
3). Физические свойства.
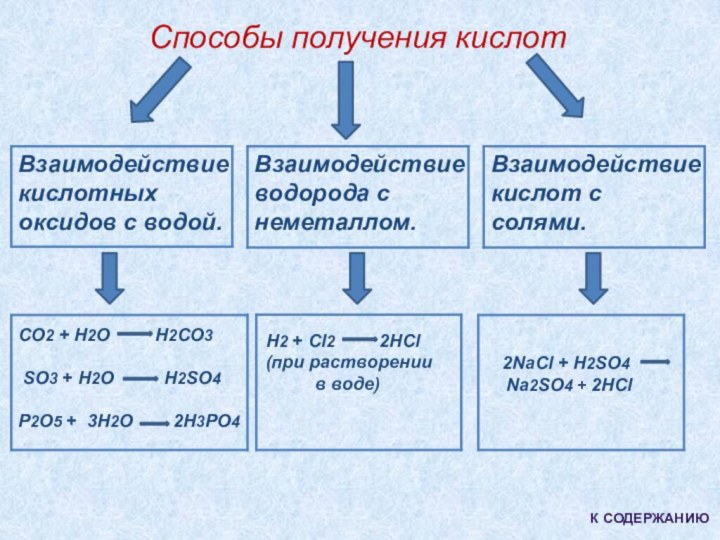
4). Способы получения.
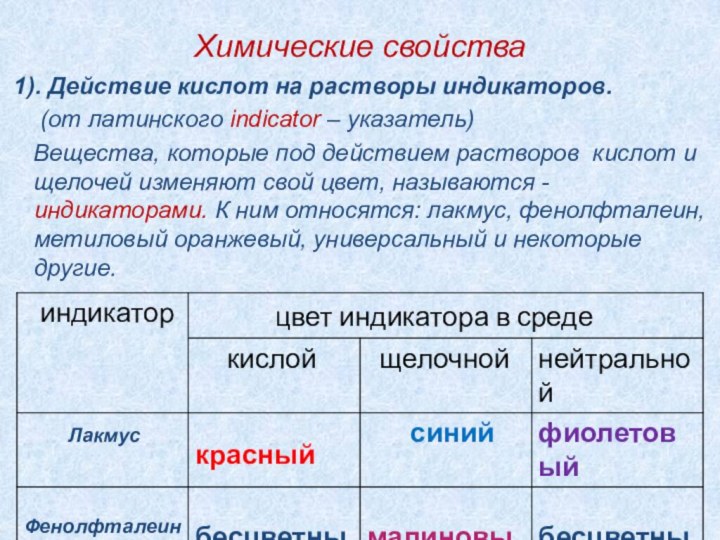
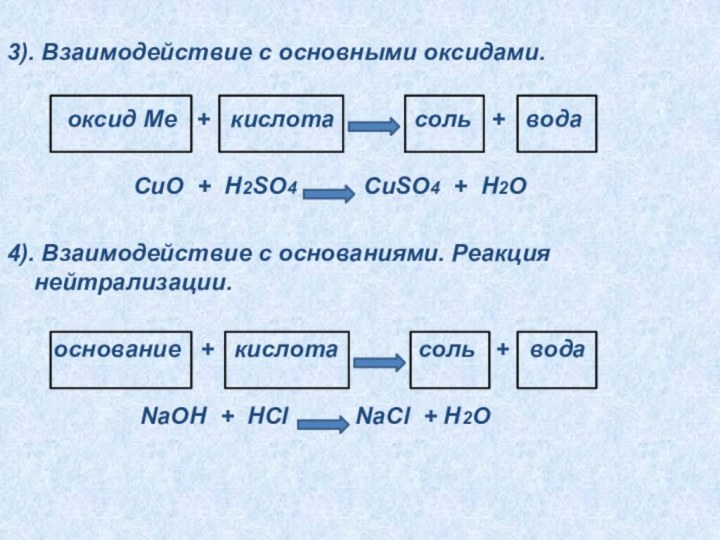
5). Химические свойства.
6). Техника безопасности при работе с кислотами.
7). Вопросы для повторения.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть












К содержанию
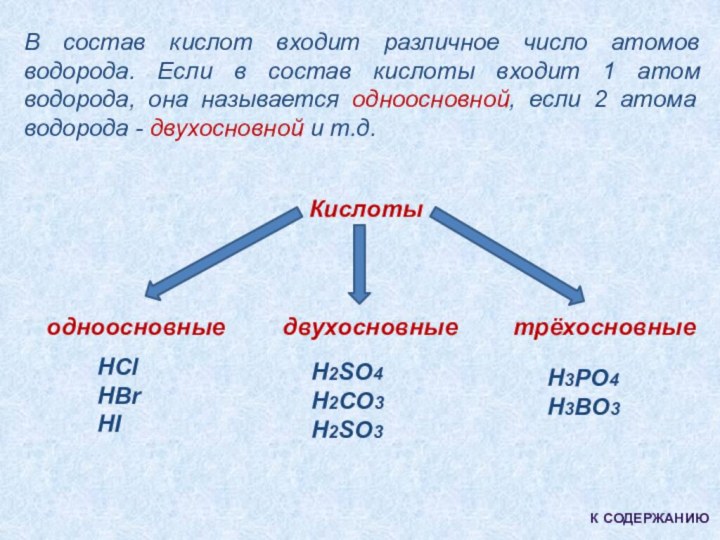
Кислоты
одноосновные
двухосновные
трёхосновные
HCl
HBr
HI
H2SO4
H2CO3
H2SO3
H3PO4
H3BO3
К содержанию
К содержанию
H2 + Cl2 2HCl
(при растворении
в воде)
2NaCl + H2SO4
Na2SO4 + 2HCl
К содержанию
К содержанию
К содержанию