соединением кислотных или основных свойств в зависимости от условий
( чаще всегоот среды реакции).
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть















Э(OH)n
?
основные? кислотные ?
Акцептор Н+
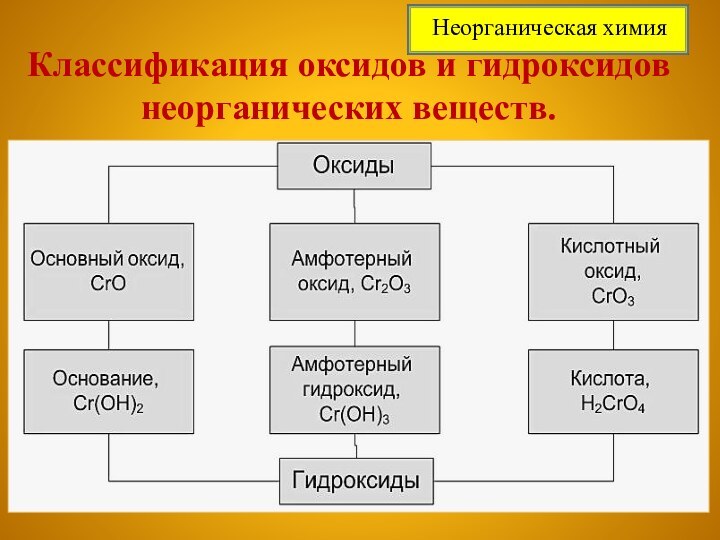
Неорганическая химия
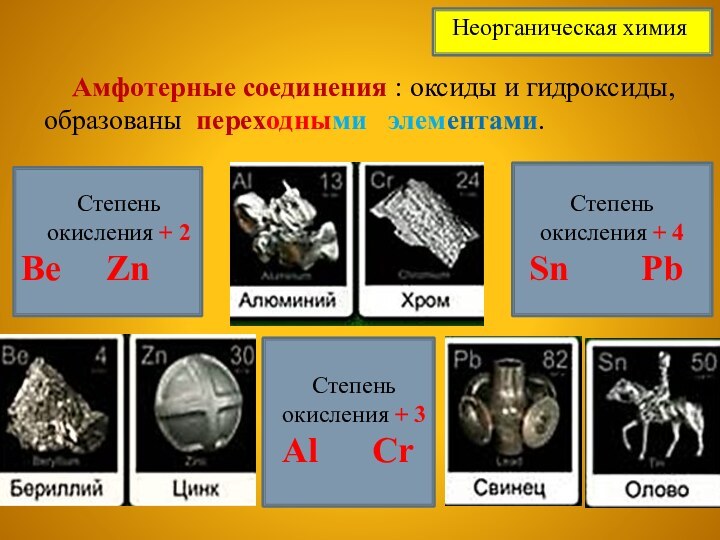
Степень окисления + 3
Al Cr
Степень окисления + 4
Sn Pb
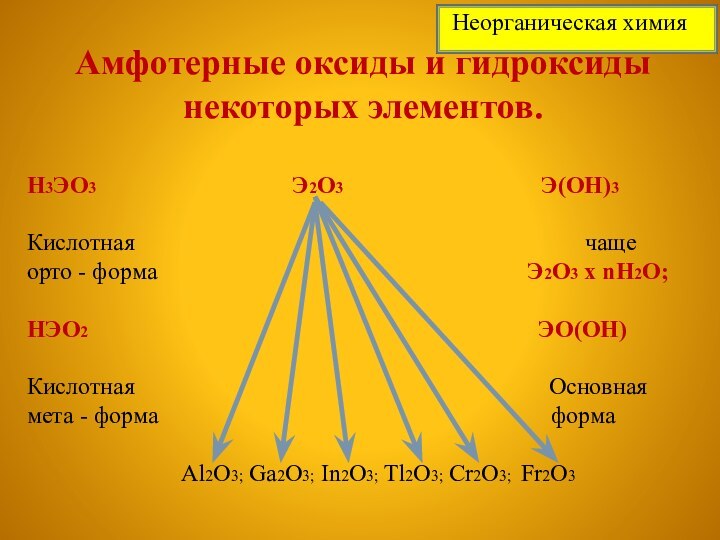
Неорганическая химия
Неорганическая химия
Н2О
среда кислая среда щелочная
+ (Н +) - (Н+)
Итог: основание ; кислота
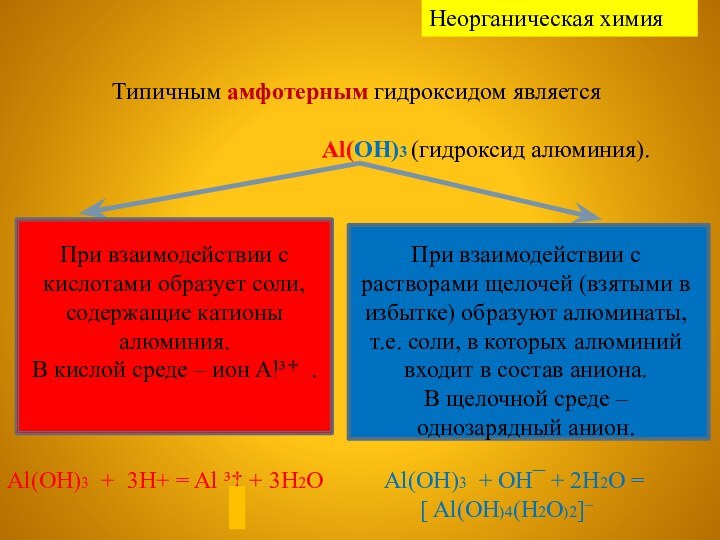
Неорганическая химия
При взаимодействии с кислотами образует соли, содержащие катионы алюминия.
В кислой среде – ион Al³‡...
При взаимодействии с растворами щелочей (взятыми в избытке) образуют алюминаты, т.е. соли, в которых алюминий входит в состав аниона.
В щелочной среде – однозарядный анион.
Al(OH)3 + 3H+ = Al ³‡ + 3H2O
Al(OH)3 + OH¯ + 2H2O =
[ Al(OH)4(H2O)2]¯
Условия течения реакций влияют на образование конечного продукта:
Вещества берутся в твердом виде и спекаются. Образуются твердые соединения – мета- и ортоформы.
Вещества берутся в растворах. Образуются комплексные соединения.
Неорганическая химия
Неорганическая химия
Альфред Вернер
(1866 – 1919)
Неорганическая химия
триптофан изолейцин тирозин
Органическая химия
Составить итоговое сокращенное ионное уравнение.
Зафиксировать в отчетный листок наблюдения.
Al(OH)3 + NaOH = Na[Al(OH)4]
кислота раствор тетра-гидроксо-алюминат натрия
Зафиксировать наблюдения.
Составить характеристику комплексному соединению:
строение внутренней сферы ---
комплексообразователь ---
лиганды ---
координационное число комплексообразователя ---
Al(OH)3 + 3HCl = AlCl3 + 3H2O
основание хлорид алюминия
Составить итоговое сокращенное ионное уравнение.
Зафиксировать в отчетный листок наблюдения.