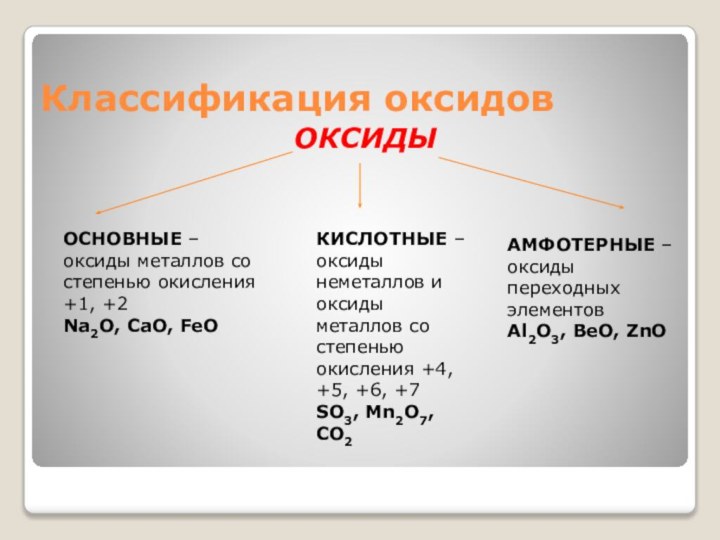
+1, +2
Na2O, CaO, FeO
КИСЛОТНЫЕ – оксиды неметаллов и оксиды
металлов со степенью окисления +4, +5, +6, +7SO3, Mn2O7, CO2
АМФОТЕРНЫЕ – оксиды переходных элементов
Al2O3, BeO, ZnO