- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аммиак. Получение. Применения. Материалы к перевернутому уроку.
Содержание
- 2. АММИАК – бесцветный газ с резким запахом,
- 3. Резкий запах аммиака известен человеку с доисторических
- 4. Молекула аммиака имеет форму тригональной пирамиды с
- 5. Химические свойства1.Взаимодействует с кислотами: NH3 +
- 6. Биологическая рольАммиак является конечным продуктом азотистого обмена
- 7. Применения В основном используется для производства
- 8. Получение аммиакаПромышленный способ получения аммиака основан на
- 9. В промышленных условиях использован принцип циркуляции -
- 10. Гидроксид аммонияСлабое основание, образующееся при взаимодействии аммиака
- 11. При отравлении аммиаком нужно принять следующие меры:
- 12. Скачать презентацию
- 13. Похожие презентации
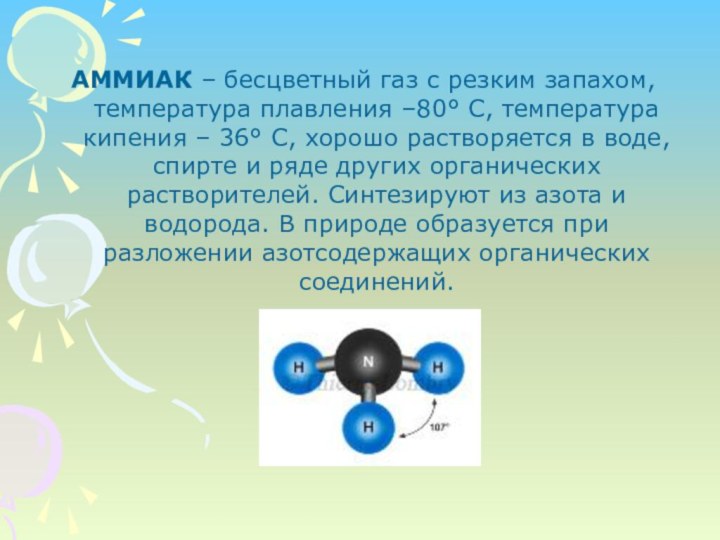
АММИАК – бесцветный газ с резким запахом, температура плавления –80° С, температура кипения – 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении










Слайд 3 Резкий запах аммиака известен человеку с доисторических времен,
так как этот газ образуется в значительных количествах при
гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.Слайд 4 Молекула аммиака имеет форму тригональной пирамиды с атомом
азота в вершине. Три не спаренных p-электрона атома азота
участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N-H), четвёртая пара внешних электронов является не поделённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4. Благодаря тому, что не связывающее двух электронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Слайд 5
Химические свойства
1.Взаимодействует с кислотами:
NH3 + HNO3
→ NH4NO3
2. Галогены (хлор, йод) образуют с аммиаком
опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот). 3. С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
4. При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
Слайд 6
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в
организме человека и животных. Он образуется при метаболизме белков,
аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину).
Слайд 7
Применения
В основном используется для производства азотных
удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и
полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.В холодильной технике используется в качестве холодильного агента (R717)
Слайд 8
Получение аммиака
Промышленный способ получения аммиака основан на прямом
взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔ 2NH3(г) +
45,9 кДжЭто так называемый процесс Габера (немецкий физик, разработал физико-химический основы метода). Реакция происходит с выделением тепла и понижением объёма. процесс получения аммиака проводят при следующих условиях: температура 500°C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30%. В промышленных условиях использован принцип циркуляции - аммиак удаляют охлаждением.
Слайд 9 В промышленных условиях использован принцип циркуляции - аммиак
удаляют охлаждением,а не прореагировавшие азот и водород возвращают в
колонну синтеза. Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Для осушения аммиака его пропускают через смесь извести с едким натром.
Слайд 10
Гидроксид аммония
Слабое основание, образующееся при взаимодействии аммиака с
водой:
NH3 + H2O ↔ NH4OH.
Реакция образования гидроксида аммония
обратима, поэтому в водных растворах гидроксид аммония находится в равновесии с аммиаком, обусловливающим резкий запах таких растворов. Водные растворы аммиака, в которых он существует преимущественно в форме гидроксида аммония, носят название аммиачная вода
Слайд 11
При отравлении аммиаком нужно принять следующие меры:
промыть
глаза и лицо водой, надеть противогаз или ватно-марлевую повязку,
смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.





























