- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Нахождение молекулярной массы веществ. Расчет массовой доли элемента в веществе.
Содержание
- 2. ПознакомимсяWArMrnмассовая доляотносительная атомная массаотносительная молекулярная массаколичество атомов элемента молекуле
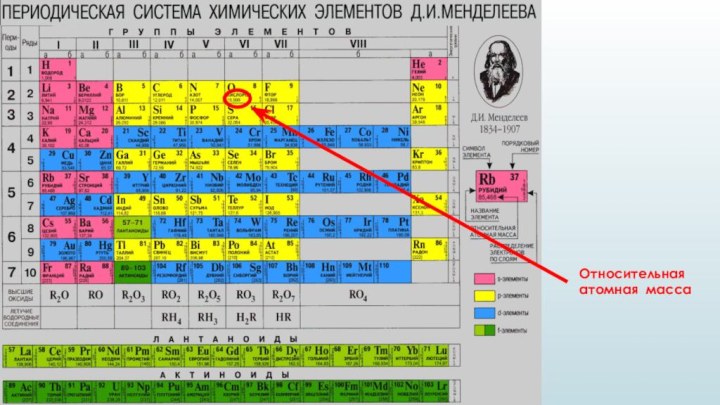
- 3. Относительная атомная масса
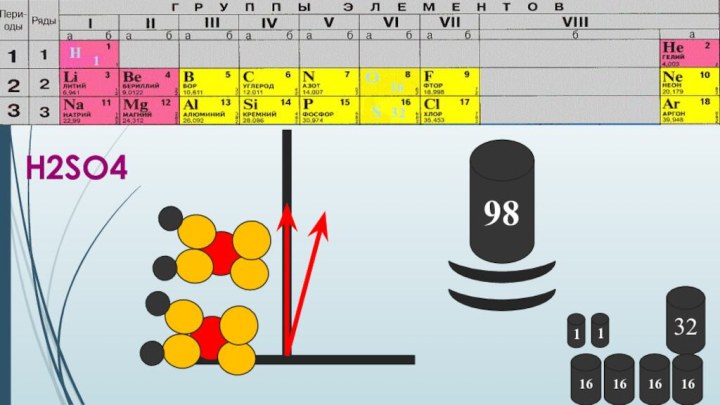
- 4. H2SO4983216161616H1О16S3211
- 5. Относительная атомная масса (Ar) - безразмерная величина, равная
- 6. Массовая доля атомов элемента в данном веществе
- 7. ЗАДАНИЕ №1Вычислите массовые доли элементов в фосфорной
- 8. ЗАДАНИЕ №2Установите формулу вещества, которое состоит из углерода (w=25%) и алюминия (w=75%).
- 9. Скачать презентацию
- 10. Похожие презентации
ПознакомимсяWArMrnмассовая доляотносительная атомная массаотносительная молекулярная массаколичество атомов элемента молекуле







Слайд 2
Познакомимся
W
Ar
Mr
n
массовая доля
относительная атомная масса
относительная молекулярная масса
количество атомов элемента
молекуле
Слайд 5 Относительная атомная масса (Ar) - безразмерная величина, равная отношению
средней массы атома элемента (с учетом процентного содержания изотопов
в природе) к 1/12 массы атома 12C.Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Пример: Определить молекулярную массу вещества B2O3
Слайд 6 Массовая доля атомов элемента в данном веществе ω
(Э) – это отношение относительной атомной массы этого элемента (Ar(X)),
умноженной на число его атомов в молекуле (индекс) (n), к относительной молекулярной массе вещества (Mr).Ar(Э) n Ar(Э) n 100%
ω (Х)= Mr(вещества) или ω (Х)= Mr(вещества)
Пример: Определить массовые доли (%) углерода и кислорода в углекислом газе СО2.