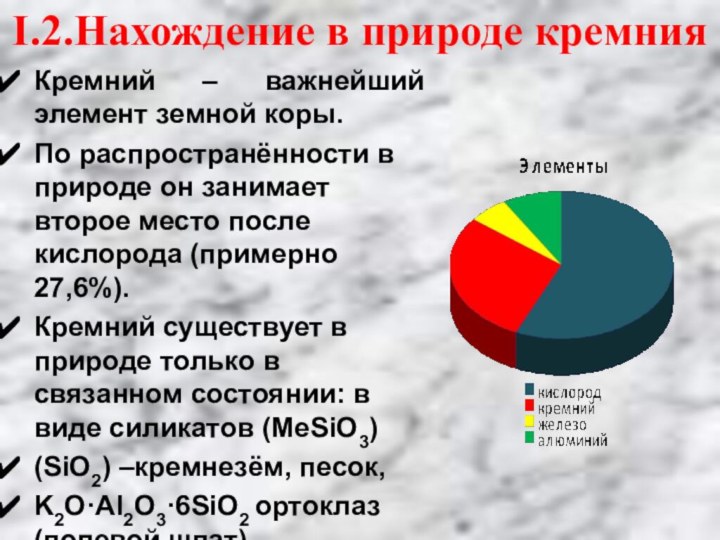
2.Моделировать химические свойства кремния
3.Давать характеристику оксиду
кремния
и рассматривать его св-ва.4.Давать характеристику кремниевой кислоте и рассматривать её св-ва.
5.Писать уравнения реакций
6.Осуществлять рефлексию своей деятельности
В результате изучения темы ,вы будете способны: