Слайд 2
АКТУАЛЬНОСТЬ, НОВИЗНА И ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ ПРОЕКТА
Решение расчетных задач

по химии для многих учеников средней школы является очень
трудным делом, для некоторых – практически непреодолимым. По мнению многих из них каждая расчётная задача требует особого подхода к её решению, применению отдельного алгоритма. Однако, в ходе решения любой расчётной задачи используются простые математические формулы, которые можно заложить в компьютерную программу Microsoft Excel, и применяются простые арифметические действия, которые быстро и точно может выполнить компьютер. Остаётся только ввести в программу данные задачи, правильно подобрать коэффициенты в уравнении химической реакции и подсчитать молярные массы веществ. Так как решением расчётных задач являются числа, то работа созданной компьютерной программы будет напоминать работу обычного арифметического калькулятора. Поэтому эту программу можно назвать химическим калькулятором.
Созданный нами химический калькулятор можно использовать для быстрого решения расчётных химических задач тестового характера, где не надо показывать подробный ход решения, а также для проверки решения расчетных задач, произведенного, так сказать, «вручную». Он призван играть такую же роль в химических расчётах, какую играет обычный бытовой калькулятор в нашей повседневной жизни.
Представленный проект химического калькулятора является оригинальным продуктом, не имеющим аналогов среди компьютерных программ, представленных в Интернете.
Слайд 3
ЦЕЛИ И ЗАДАЧИ
Цель проекта:
- создание химического калькулятора
для решения расчётных
химических задач различных типов.
Задачи:
-
выбрать типы расчётных задач, для решения которых можно
создать калькулятор;
- составить математические формулы для ввода их в калькулятор;
- создать дизайн калькулятора для каждого типа расчётных задач;
- ввести математические формулы в соответствующие ячейки
программы;
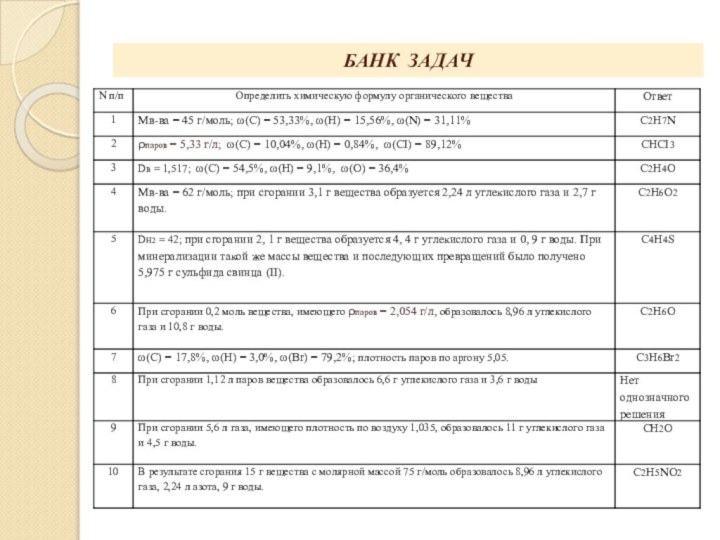
- проверить работу химического калькулятора на примерах,
взятых из банка расчётных задач;
- показать принципиальную возможность создания калькулятора
для решения любых расчётных задач по химии.
Слайд 4
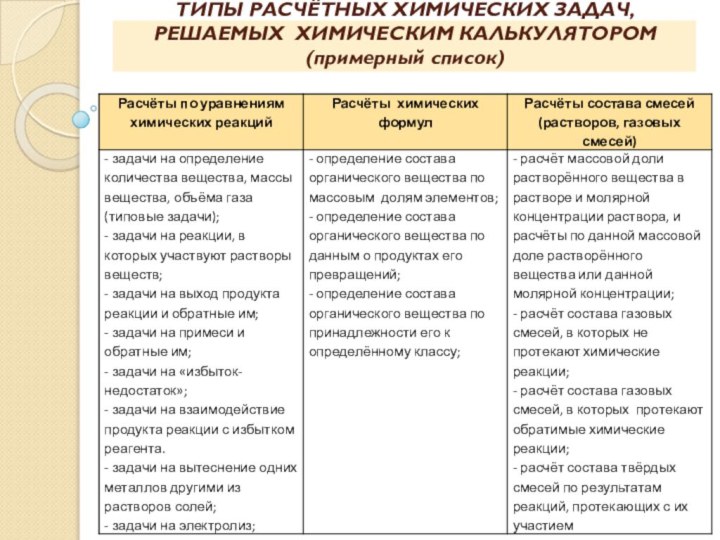
ТИПЫ РАСЧЁТНЫХ ХИМИЧЕСКИХ ЗАДАЧ, РЕШАЕМЫХ ХИМИЧЕСКИМ КАЛЬКУЛЯТОРОМ (примерный
список)
Слайд 5
Расчёты по уравнениям химических реакций
- задачи на определение
количества вещества, массы
вещества, объёма газа
(типовые задачи);
- задачи на реакции, в которых участвуют растворы
веществ;
- задачи на выход продукта реакции и обратные им;
- задачи на примеси и обратные им.
Слайд 6
МАТЕМАТИЧЕСКИЙ АППАРАТ КАЛЬКУЛЯТОРА
В основе решения любой расчётной задачи

по уравнению химической реакции лежит математическая формула: υ2
= υ1*n2/n1, где υi – количества веществ (моль),
ni – коэффициенты в уравнении химической реакции. Индекс 1 относится к веществу, для которого приведены данные в условии задачи (так называемое, «известное вещество»). Индекс 2 относится к веществу, для которого надо найти какие-либо величины, указанные в условии задачи (так называемое, «неизвестное вещество»). Перевод физических величин в количество вещества и обратно осуществляется по формулам: υ = m/M, υ = V/Vm,
m = υ * M, V = υ * Vm, где m – масса вещества (г), M – молярная масса вещества (г/моль), V – объём газа или паров вещества (л), Vm – молярный объём газов (22,4 л/моль при н.у.).
Если в условии задачи даны смеси (растворы) веществ, то вместо массы вещества (m) используют произведение массы смеси (mсм) на массовую долю вещества в смеси (ω), а вместо объёма газа (пара) – произведение объёма смеси (Vсм) на объёмную долю газа (пара) в смеси (φ):
m = mсм * ω, V = Vсм * φ
Если по условию задачи требуется найти массу смеси или массовую долю вещества в смеси, то используют формулы:
mсм = m/ω, Vсм = V/φ, ω = m/mсм, φ = V/Vсм
Для расчёта доли выхода продукта реакции (η) или практической массы (mпр.) и практического объёма (Vпр.) используют формулы:
η = mпр./mтеор., η = Vпр./Vтеор., mпр. = mтеор. * η, Vпр. = Vтеор. * η, где mтеор. и Vтеор. – масса или объём вещества в газообразном состоянии, рассчитанные по уравнению химической реакции.
Слайд 8
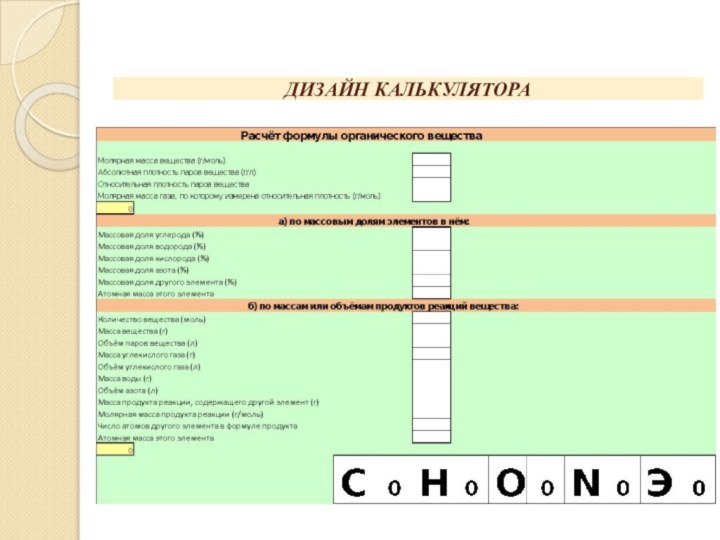
СОЗДАНИЕ КАЛЬКУЛЯТОРА
В ячейку F2 вводим химическую формулу «известного»

вещества, в ячейку I2 вводим химическую формулу «неизвестного» вещества.
В ячейки E2 и H2 вводим соответствующие коэффициенты в уравнении химической реакции, а в ячейки F3 и I3 - численные значения молярных масс соответствующих веществ. В ячейки столбца F вводим численные данные задачи, в ячейках столбца I записываем расчётные формулы. В ячейке A17 записываем формулу для расчёта количества «известного вещества», в ячейке A18 записываем отношение коэффициентов n2/n1. Чтобы исключить ноль из знаменателя к нему прибавляем некоторое малое число, которое не будет искажать конечного результата, и для того, чтобы компьютер не заблокировал ответ задачи. Количество «известного» вещества представляем в виде суммы:
υ1 + (m1/M1) + (V1/Vm) + (mсм*ω1/M1) + (Vсм*φ/Vm) + (mпр/η*M1) + (Vпр/η*Vm)
С учётом того, что массовая, объёмная доли и доля выхода продукта реакции выражены в процентах, деление на Vm заменено множителем 0,04464 и введено слагаемое 0,000001 в знаменатель для снятия неопределённости, формула в ячейке A17 будет следующей: см. слайд 7.
В ячейках столбца I записываются формулы для вычисления соответствующих величин:
I5: А17*А18 I6: I3*I5 I7: 22,4*I5
I8: 100*I6/(F9+0,0000001) I9: 100*I6/(F8+0,0000001) I10: 100*I7/(F11+0,0000001)
I11: 100*I7/(F10+0,0000001) I12: 100*(F13/(I6+0,0000001))+100*(F14/(I7+0,0000001))
I13: 0,01*F12*I6 I14: 0,01*F12*I7 I15: 0,01*F12*I6 I16: 0,01*F12*I7
Слайд 10
Расчёты химических формул
- определение состава органического вещества по
массовым долям элементов;
- определение состава органического
вещества по
данным о продуктах его превращений;
Слайд 11
МАТЕМАТИЧЕСКИЙ АППАРАТ КАЛЬКУЛЯТОРА
Большинство органических веществ, изучаемых в средней

школе, содержат не более пяти химических элементов: углерод, водород,
кислород, азот и либо галоген, либо фосфор или серу. Массовая доля (ω) элемента в веществе рассчитывается по формуле:
ω(Э) = n(Э)*A(Э)/M, где n(Э) – число атомов данного элемента в химической формуле вещества, A(Э) – атомная масса данного элемента, М – молекулярная(молярная) масса вещества, откуда n(Э) = ω(Э) * M/A(Э). Молярная масса вещества либо даётся в условии задачи, либо приводятся данные для её расчёта – абсолютная или относительная плотность газа или пара: М = ρ*Vm, М = Dг*Mг, где ρ - абсолютная плотность газа или пара данного вещества (г/л), Vm – молярный объём газов (22,4 л/моль при н.у.), Dг – относительная плотность газа или пара данного вещества по какому-либо газу г, Mг – молярная масса газа г (г/моль).
Анализ органического вещества осуществляется либо методом его окисления (сжигания), либо его минерализацией с последующим анализом продуктов превращений. При окислении углерод и водород, содержащиеся в веществе, переходят в оксиды – углекислый газ и воду, азот выделяется в виде молекулярного азота. Галогены, серу, фосфор при минерализации переводят в нерастворимые в воде галогениды (кроме фторида) серебра, фосфат серебра, сульфид свинца с последующим определением масс этих продуктов. Количество элемента в органическом веществе будет равно количеству продукта превращения, умноженному на число атомов данного элемента в химической формуле продукта. Так, количества галогенов, серы, фосфора, углерода будут равны количествам продуктов превращения, содержащих данные элементы, поскольку в химических формулах этих веществ присутствует только один атом этих элементов. Количество водорода и азота будет равно удвоенному количеству воды и молекулярного азота, поскольку число атомов этих элементов в формуле воды и азота равно двум.
Слайд 13
СОЗДАНИЕ КАЛЬКУЛЯТОРА
В основе расчета состава органического вещества лежит

математическая формула
n(Э) = υ(Э)/υв-ва
Молярную массу вещества (Mв-ва )
представляем в виде суммы:
M + ρ*Vm + Dг*Mг и записываем её в отдельной ячейке A7.
Количество вещества представляем в виде суммы: υв-ва + mв-ва/Mв-ва + Vв-ва/Vm и записываем её в ячейке А27.
В ячейке Н28 записываем формулу для расчёта числа атомов углерода:
n(C) = ω(C) (%) * Mв-ва /(100 * A(C)) + ((m(CO2)/M(CO2) + (V(CO2)/Vm))/υв-ва
Н28 = (0,000833*I9*A7)+((0,02273*I19+0,04464*I20)/(A27+0,0001))
В ячейке J28 записываем формулу для расчёта числа атомов водорода:
n(Н) = ω(Н) (%) * Mв-ва /(100 * A(Н)) + ((2*m(Н2O)/M(Н2O)/υв-ва)
J28 = (0,01*I10*A7)+(0,111*I21/(A27+0,0001))
В ячейке N28 записываем формулу для расчёта числа атомов азота:
n(N) = ω(N) (%) * Mв-ва /(100 * A(N)) + ((2*V(N2)/Vm)/υв-ва)
N28 = (0,0007142*I12*A7)+(0,08929*I22/(A27+0,0001))
В ячейке P28 записываем формулу для расчёта числа атомов дополнительного элемента:
n(Э) = ω(Э) (%) * Mв-ва /(100 * A(Э)) + (n(Э)прод.* m прод / Mпрод.* υв-ва)
P28 = (0,01*I13*A7/(I14+0,0001))+(I23*I25/(I24*A27+0,0001))
В ячейке L28 записываем формулу для расчёта числа атомов кислорода:
n(О) = (Mв-ва - n(C)*A(C) - n(Н)*A(Н) - n(N)*A(N) - n(Э)*A(Э))/А(О)
L28 = 0,0625*(A7-12*H28-J28-14*N28-I26*P28)