входят атомы водорода, способные замещаться или обмениваться на атомы
металла и кислотный остаток
Двухосновны
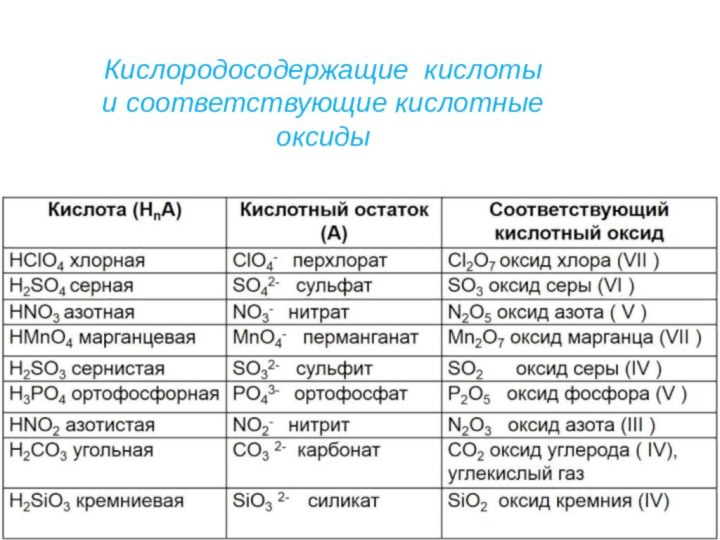
H2SO4 серная
H2SO3 сернистая
H2Sсероводородная
H2CO3 угольная
H2SiO3 кремниеваяе
Трехосновные
H3PO4 фосфорная
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть





Двухосновны
H2SO4 серная
H2SO3 сернистая
H2Sсероводородная
H2CO3 угольная
H2SiO3 кремниеваяе
Трехосновные
H3PO4 фосфорная
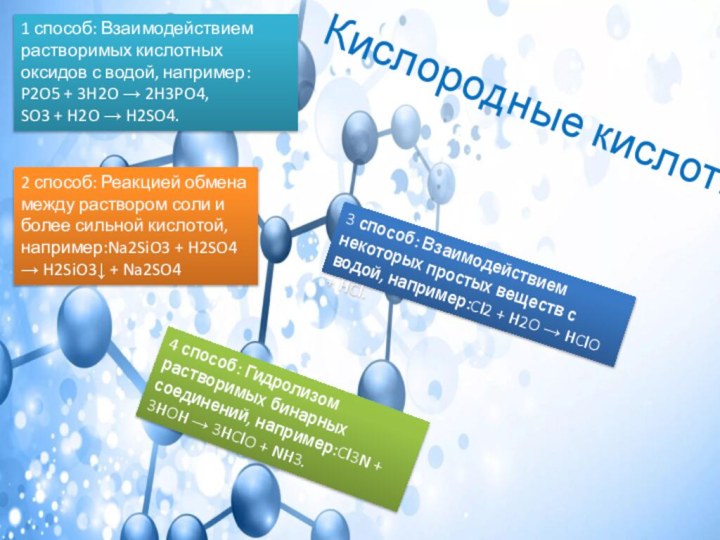
3 способ: Взаимодействием некоторых простых веществ с водой, например:
Cl2 + H2O → HCl + HClO.
Бескислородные кислоты
2 способ: Реакцией обмена между раствором соли и более сильной кислотой, например:Na2SiO3 + H2SO4 → H2SiO3↓ + Na2SO4
4 способ: Гидролизом растворимых бинарных соединений, например:Cl3N + 3HOH → 3HClO + NH3.
3 способ: Взаимодействием некоторых простых веществ с водой, например:Cl2 + H2O → HClO + HCl.