- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии по теме Строение атома
Содержание
- 2. СТРОЕНИЕ АТОМА. Цель урока: раскрыть физический смысл
- 3. СТРОЕНИЕ АТОМА. I. Атом – это химически
- 4. СТРОЕНИЕ АТОМА. АтомЯдроЭлектронная
- 5. СТРОЕНИЕ АТОМА.Изотопы – это разновидность атомов, имеющих
- 6. СТРОЕНИЕ АТОМА1.Число протонов = заряд ядраЗаряд ядра атома = порядковый номерHOS+1+8+16
- 7. СТРОЕНИЕ АТОМА2.Число электронов = число протоновчисло е- = число р+HOS+1+8+161е-8е-16е-
- 8. СТРОЕНИЕ АТОМА3. Электроны располагаются на энергетических уровнях(электронных оболочках). Число электронных оболочек= номер периодаHOS+1+8+161е-8е-16е-
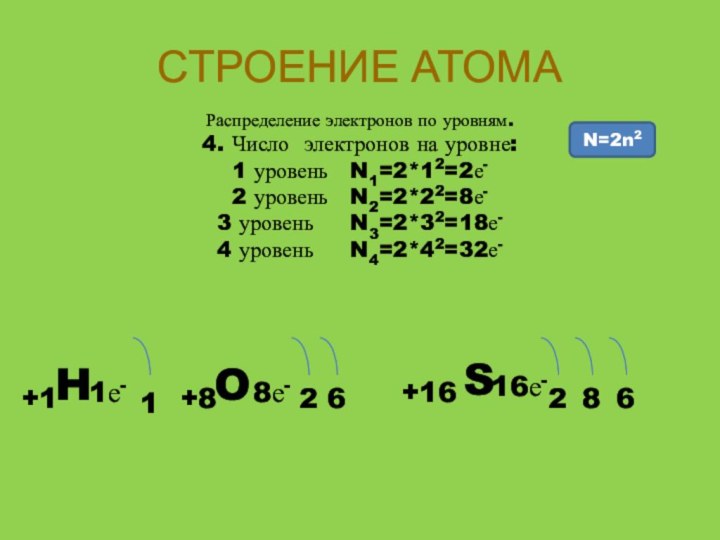
- 9. СТРОЕНИЕ АТОМАРаспределение электронов по уровням. 4. Число
- 10. СТРОЕНИЕ АТОМА§37 с.125-132Правила в тетради выучитьс. 138 №3,4
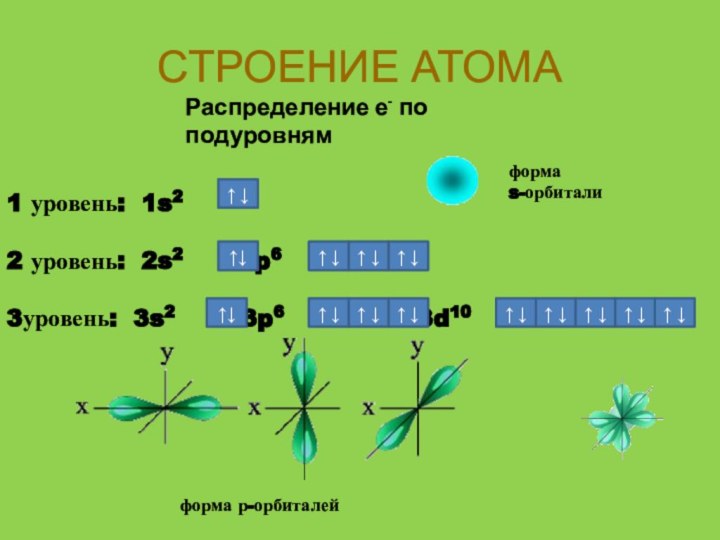
- 11. СТРОЕНИЕ АТОМАРаспределение е- по подуровням1 уровень: 1s2
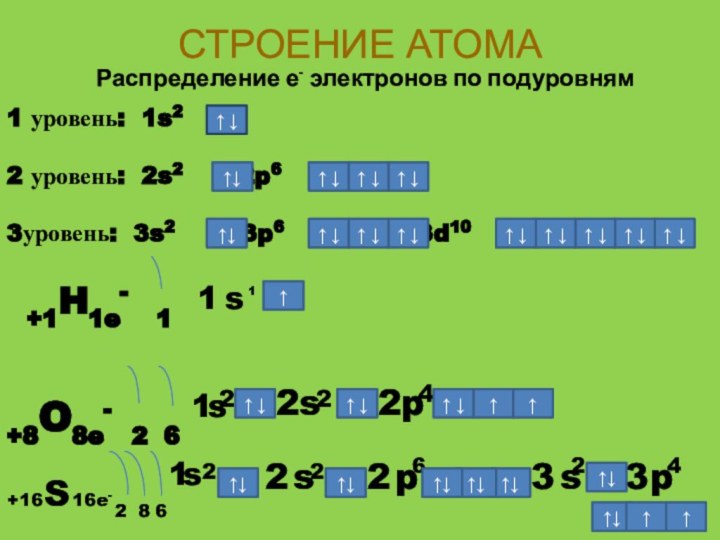
- 12. СТРОЕНИЕ АТОМАРаспределение е- электронов по подуровням1 уровень:
- 13. Периодическое изменение свойств элементов и простых веществ.I.
- 14. Периодическое изменение свойств элементов и простых веществ.В
- 15. Скачать презентацию
- 16. Похожие презентации







Слайд 2
СТРОЕНИЕ АТОМА.
Цель урока:
раскрыть физический смысл порядкового
номера химического элемента;
Слайд 3
СТРОЕНИЕ АТОМА.
I. Атом – это химически неделимая
частица.
История открытия строения атома.
Доказал, что атом имеет плотное ядро.
Предложил планетарную теорию строения атома.Э. Резерфорд
Слайд 4
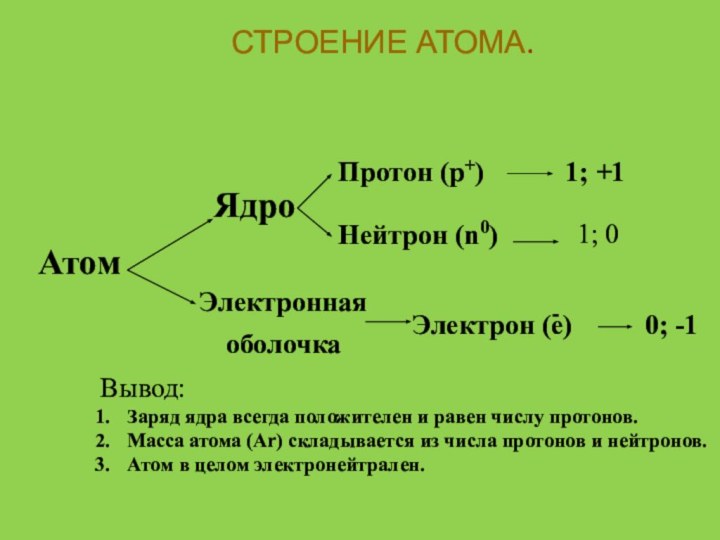
СТРОЕНИЕ АТОМА.
Атом
Ядро
Электронная
оболочка
Протон (p+)
Нейтрон (n0)
Электрон (e)
1; +1
1; 0
0; -1
Вывод:
Заряд
ядра всегда положителен и равен числу протонов.Масса атома (Ar) складывается из числа протонов и нейтронов.
Атом в целом электронейтрален.
Слайд 5
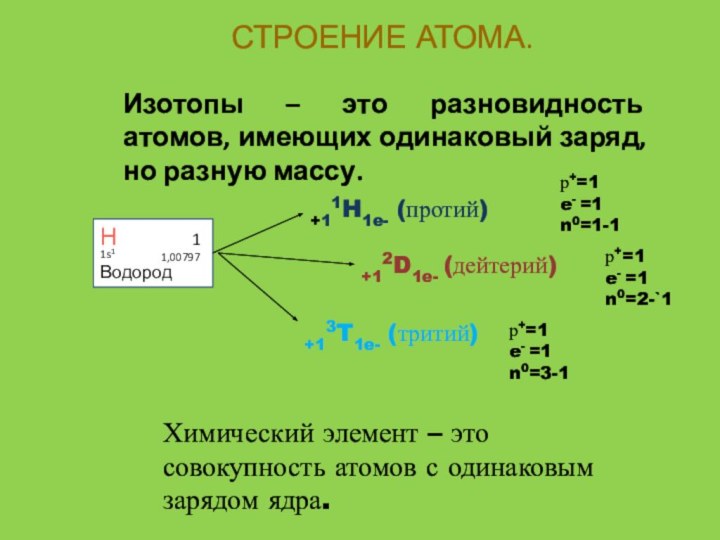
СТРОЕНИЕ АТОМА.
Изотопы – это разновидность атомов, имеющих одинаковый
заряд, но разную массу.
+11H1e- (протий)
+12D1e- (дейтерий)
+13T1e- (тритий)
Химический элемент
– это совокупность атомов с одинаковым зарядом ядра.Н
1
1,00797
1s1
Водород
р+=1
e- =1
n0=1-1
р+=1
e- =1
n0=2-`1
р+=1
e- =1
n0=3-1
Слайд 8
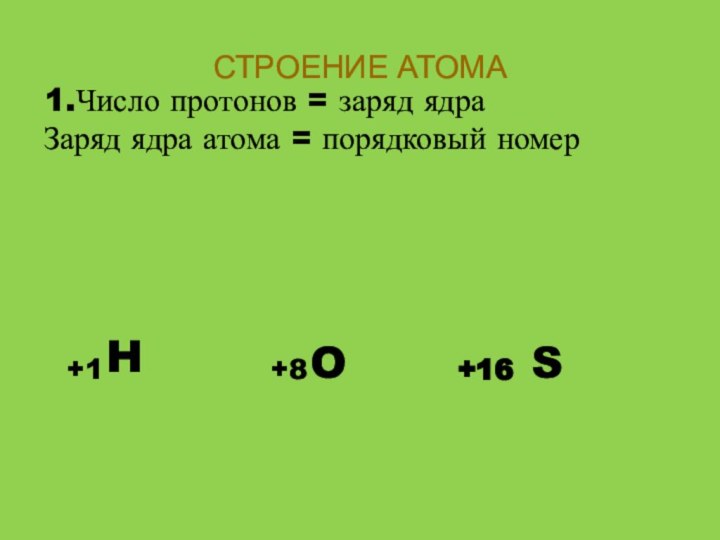
СТРОЕНИЕ АТОМА
3. Электроны располагаются на энергетических уровнях(электронных оболочках).
Число электронных оболочек= номер периода
H
O
S
+1
+8
+16
1е-
8е-
16е-
Слайд 9
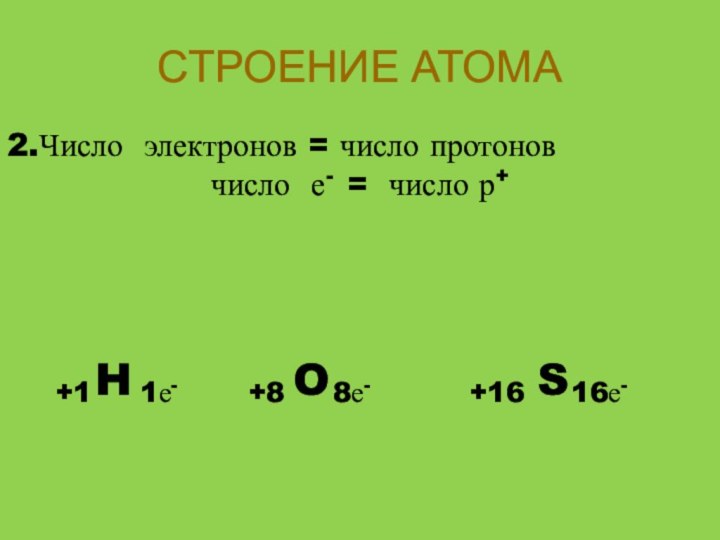
СТРОЕНИЕ АТОМА
Распределение электронов по уровням.
4. Число электронов
на уровне:
1 уровень N1=2*12=2е-
2 уровень N2=2*22=8е-
3 уровень
N3=2*32=18е-4 уровень N4=2*42=32е-
H
O
S
+1
+8
+16
1е-
8е-
16е-
1
2
6
2
8
6
N=2n2
Слайд 11
СТРОЕНИЕ АТОМА
Распределение е- по подуровням
1 уровень: 1s2
2 уровень: 2s2 2p6
3уровень: 3s2
3p6 3d10↑ ↓
↑↓
↑↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
форма
s-орбитали
форма р-орбиталей
Слайд 12
СТРОЕНИЕ АТОМА
Распределение е- электронов по подуровням
1 уровень: 1s2
2 уровень: 2s2 2p6
3уровень: 3s2
3p6 3d10↑ ↓
↑↓
↑↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
↑ ↓
+1H1e- 1
1
s
1
↑
+8O8e- 2 6
1
s
2
2
s
2
2
↑ ↓
↑ ↓
p
4
↑
↑
↑ ↓
+16
S
16e-
1
s
2
↑↓
2
s
2
↑↓
3
s
2
3
p
2
8
6
6
↑↓
↑↓
↑↓
2
↑↓
p
4
↑↓
↑
↑
Слайд 13
Периодическое изменение свойств элементов и простых веществ.
I. В
периодах с увеличением заряда ядра(слева направо):
- число энергетических уровней
не изменяется.число электронов на последнем уровне увеличивается
и равно номеру группы.
- металлические свойства ослабевают.
Слайд 14
Периодическое изменение свойств элементов и простых веществ.
В главных
подгруппах с возрастанием заряда ядра
(сверху вниз):
- число энергетических
уровней увеличивается.- число электронов на последнем уровне не изменяется.
- металлические свойства усиливаются.
Современная формулировка периодического закона:
Свойства простых веществ и образуемых ими сложных находятся в периодической зависимости от величины заряда ядра атома





























