Слайд 2
Цели и задачи:
а) образовательные: систематизировать и углубить знания
учащихся о соединениях кальция и магния, дать понятие о
видах жесткости воды, об ионном механизме ее образования и устранения, проконтролировать усвоение знаний об s – элементах и их соединениях;
б) развивающие: развивать логическое мышление, познавательный интерес учащихся;
в) воспитательные: вовлечь в активную практическую деятельность;
Слайд 3
План урока
Организационный момент.
Проверка домашнего задания
Объяснение нового материала
Закрепление нового
материала
Подведение итогов
Задание на дом
Слайд 4
Проверка знаний и умений по пройденному материалу
1. Дать
общую характеристику металлам
I группы главной подгруппы
Слайд 5
2. Охарактеризуйте натрий и калий
(положение в ПС, строение
атомов, ФС, ХС, нахождение в природе, получение, применение, способы
распознавания)
Слайд 6
3. Рассказать об основных соединениях натрия
и калия
Слайд 7
4. Дать общую характеристику металлам II группы главной
подгруппы
Слайд 8
5. Дать сравнительную характеристику магния и кальция (положение
в ПС, строение атомов, ФС, ХС, нахождение в природе,
получение, применение, способы распознавания)
Слайд 9
6. Охарактеризуйте соединения кальция и магния.
Их роль в
природе.
Слайд 10
Осуществите следующие превращения:
Na→NaOH→Na2CO3→NaCl→Na
Mg→MgO→MgSO4→Mg(OH)2→Mg(NO3)2
Слайд 11
Тема урока:
«Жесткость воды
и способы ее устранения»
Слайд 12
Насколько «жестка» жесткая вода?

Вода, содержащая ионы кальция и магния, называется жёсткой. Накипь
на стенках нагревательных котлов, отложения солей на бытовой технике, и т.д. - все это показатели жесткой воды. Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. При большом содержании ионов магния, вода горьковата на вкус и оказывает послабляющее действие на кишечник. Различают карбонатную и некарбонатную жесткость. Карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2.
При кипячении гидрокарбонаты разрушаются с образованием осадков малорастворимых карбонатов CaCO3, жесткость уменьшается, поэтому карбонатную жесткость называют временной. При кипячении ионы Mg2+ и Ca2+ осаждаются в виде карбонатов. Жесткость, сохраняющаяся после кипячения воды, называется постоянной или некарбонатной. Она обусловлена растворенными в воде кальциевыми и магниевыми солями сильных кислот (сульфатами и хлоридами).
Слайд 13
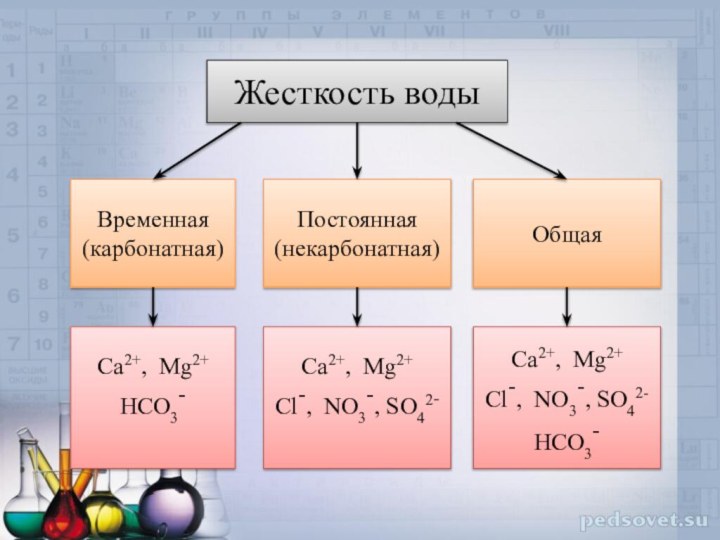
Жесткость воды
Временная (карбонатная)
Постоянная (некарбонатная)
Общая
Са2+, Mg2+
HCO3-
Са2+, Mg2+
Cl-, NO3-, SO42-
Са2+,
Mg2+
Cl-, NO3-, SO42-
HCO3-
Слайд 14
Умягчение воды – процесс снижения жесткости воды, т.е.
уменьшение концентрации ионов кальция и магния. Жесткая вода негативно
сказывается на здоровье человека, на работе сантехнического и котельного оборудования. Поэтому, чтобы не испортить оборудование, требуется умягчение воды.
Слайд 15
Способы устранения жесткости воды
Временная (карбонатная) устраняется:
кипячением:
Ca(HCO3)2 =t=˃ CaCO3↓+CO2↑+H2O
добавлением
известкового молока:
Ca(HCO3)2 +Ca(OH)2=2 CaCO3↓+2H2O
добавлением соды:
Mg(HCO3)2 +Na2CO3=MgCO3↓+2NaHCO3
Слайд 16
Постоянная (некарбонатная) устраняется:
добавлением соды:
CaCl2 + Na2CO3 = CaCO3↓
+ 2NaCl
с помощью ионообменных фильтров
ионы
кальция и магния заменяют на
ионы натрия и калия
3) с помощью бытовых фильтров (отфильтрованная вода дает меньше
накипи, что важно при использовании электрочайников)
Слайд 17
Общая жесткость
устраняется:
добавлением ортофосфата натрия:
3MgSO4
+ 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4
Полностью очистить воду от
солей можно методом перегонки (дистилляцией)
Слайд 18
Влияние жесткости воды на здоровье человека

Повышенная жесткость воды негативно сказывается на
здоровье человека при умывании. Соли жесткости взаимодействуют с моющими веществами и образуют нерастворимые шлаки. Эти шлаки высыхают и остаются в виде микроскопической корки на кожном и волосяном покрове человека. Разрушается естественная жировая пленка кожного и волосяного покрова человека, забиваются поры, появляется сухость, шелушение, перхоть. Признак повышенной жесткости воды – скрип чисто вымытой кожи и волос. Чувство повышенной мылкости, признак того, что защитная пленка на коже невредима, и жесткость воды небольшая. Поэтому косметологи советуют умываться дождевой или талой водой. С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения. Кроме того, при взаимодействии солей жесткости с моющими веществами происходит образование "мыльных шлаков" в виде пены, она после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах.
Слайд 19
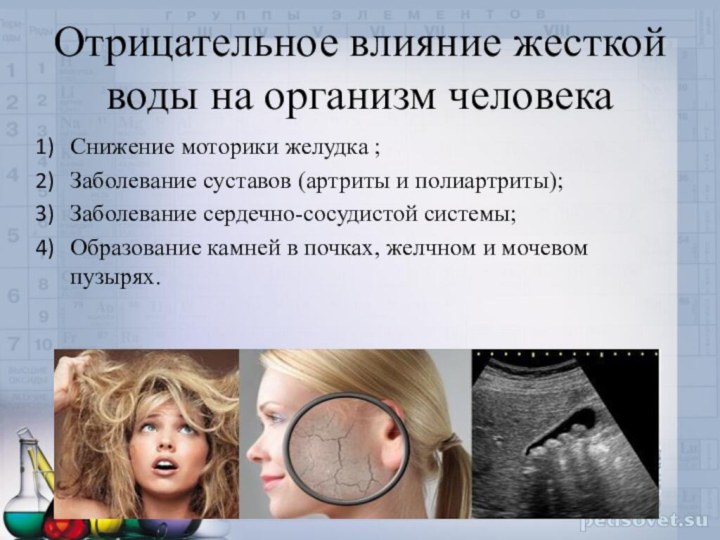
Отрицательное влияние жесткой воды на организм человека
Снижение моторики
желудка ;
Заболевание суставов (артриты и полиартриты);
Заболевание сердечно-сосудистой системы;
Образование камней
в почках, желчном и мочевом пузырях.
Слайд 20
Отрицательное влияние мягкой воды на организм человека
Вымывает кальций
из костей;
Ломкость костей у взрослого человека;
Риск развития рахита у
детей;
Вымывает минеральные вещества и полезные бактерии.
Слайд 21
Вред, наносимый жесткой водой технике и предметам быта
Кроме
плохого вспенивания мыльных средств, из-за контакта жесткой воды с
ними образуются разводы и твердый налет на сантехнике и поверхности посуды, так как выпадает солевой осадок. Такой налет тяжело отмывается с посуды, а так же негативно влияет на сантехнику, постепенно разрушая ее поверхности.
В процессе нагревания воды в электроприборах соли кристаллизуются и выпадают
в виде накипи. Именно накипь является основной причиной быстрой поломки водонагревательных приборов.
Жесткая вода оставляет пятна, разводы и грязные налеты на свежевыстиранных вещах, цвет тускнеет, рисунки становятся серыми. От них избавиться очень сложно и это, требует повышенных затрат моющих средств. Ткань, постиранная в жесткой воде, становится грубой и неэластичной, потому что соли забивают в ней все свободное пространство. Уменьшается прочность одежды и белья.
Слайд 22
В последнее время появилось множество смягчителей воды, защищающих
стиральные машины от накипи. Одновременно производители стиральных порошков ввели
компоненты предотвращающие образование накипи.
Calgon - снижает жесткость воды на 100%.
Слайд 23
Задача:
Жесткость воды часто выражается в градусах. Один градус
соответствует
7,1 мг ионов Ca2+ в
1 литре воды.
Образец воды содержит 50 мг ионов Ca2+
в 1 литре. Определите жесткость воды в градусах.
Слайд 24
Лабораторный опыт
Определение жесткой воды.
Задание: определите в каком
стакане находится жесткая вода.
Оборудование и реактивы: стаканы, стеклянная
палочка, вода с разных источников, раствор хозяйственного мыла.
Выполнения опыта:
Налейте в два стакана по 10 мл раствора мыла.
Интенсивно перемешайте содержимое первого стакана,
а затем второго.
В каком стакане образуется больше мыльной пены? Почему?
Слайд 25
Вывод: в жесткой воде хозяйственное мыло
не пенится, так как:
2C17H35COONa +
CaSO4 = (C17H35COO)2Ca↓+ Na2SO4
стеарат натрия стеарат кальция
(мыло)
Слайд 26
Если мы хотим заботиться о своем здоровье, мы
должны больше знать о таком качестве воды, как жесткость,
о способах изменения жесткости воды. В настоящее время ведутся научные разработки и идет поиск удешевления процесса «смягчения» или увеличения жесткости воды. Но в домашних условиях мы можем и сами немного помочь себе и своему организму.
Слайд 27
Закрепление нового материала:
Какая вода называется жесткой?
Перечислите виды жесткой
воды?
Назовите способы устранения?
Какие из следующих веществ можно использовать для
смягчения жесткой воды: NaOH, H2SO4, CaCl2, Na3PO4, CaSO4, известковая вода, Na2CO3?
Слайд 28
Задача
Если жесткость воды обусловлена присутствием кальциевой селитры Са(NO3)2,
то как ее устранить?
Запишите уравнения соответствующей реакции в ионном
виде (полное и сокращенное).
Слайд 29
Задание на дом:
§ 6.8
№ 1-7 стр.
175-176