- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку химии для 9 класса по теме Щелочные металлы
Содержание
- 2. Положение в периодической системе химических элементов Д.И.МенделееваI группа главная подгруппа. Увеличивается радиус атомов ,растет восстановительная способность
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВМЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКАТвердые вещества серебристо-белого цветаЭлектропроводны и теплопроводныЛегкоплавкие. пластичные
- 5. Щелочные металлы – простые веществаЛитийНатрийЛитий и натрий
- 6. Щелочные металлыКалийРубидийКалий и рубидиймягкие щелочные металлы серебристо-белого цвета
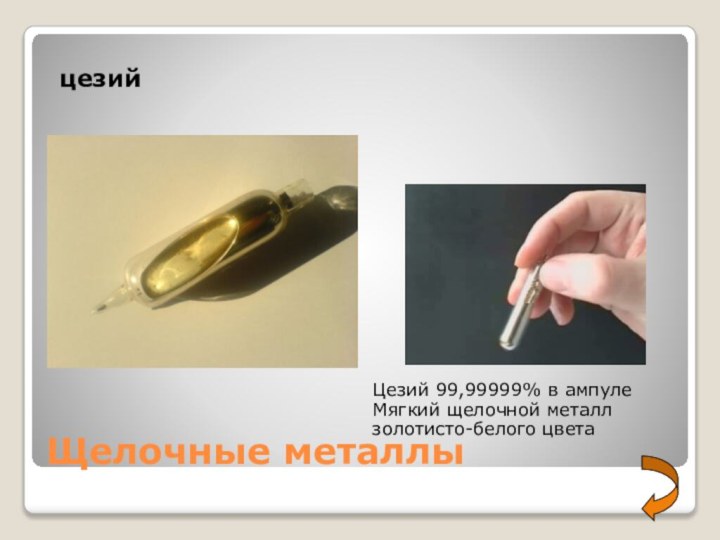
- 7. Щелочные металлыцезийЦезий 99,99999% в ампулеМягкий щелочной металл золотисто-белого цвета
- 8. ФранцийФранций - щелочной металл, обладающий как радиоактивностью,
- 9. Химические свойства щелочных
- 10. Химические свойства2Na + Cl2
- 11. Образование оксидовОксид лития образуется при реакции лития
- 12. ГидроксидыKOH – едкое калиNaOH – едкий натр,
- 13. Качественное определение щелочных металлов
- 14. 1) Электролиз расплавов соединений щелочных металлов:2МеCl =
- 15. Применение щелочных металлов
- 16. БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯответответответNaClКристалли-ческая содаNa2CO3*10H2OПитьевая содаNaHCO3поташK2CO3Калийная селитраKNO3Глауберова сольNa2SO4*10H2O
- 17. Li Охладитель в ядерных реакторахВ медицинеВ металлургии для удаления примесейПри изготовлении фарфора
- 18. К+ Внутриклеточный ион.
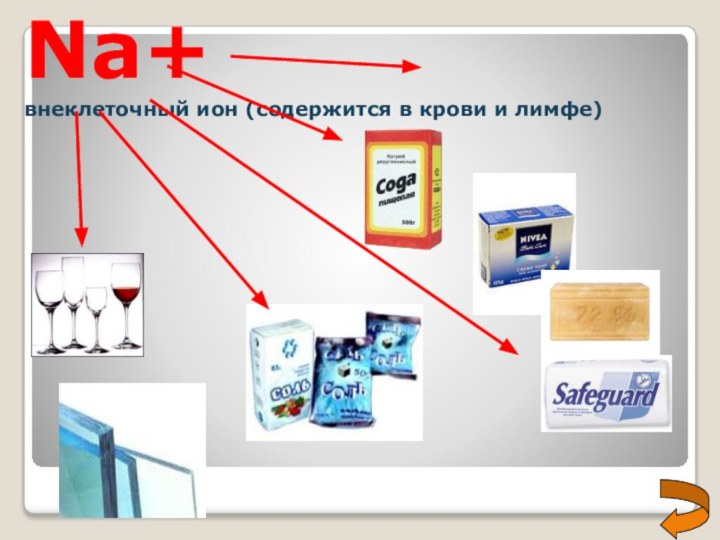
- 19. Na+
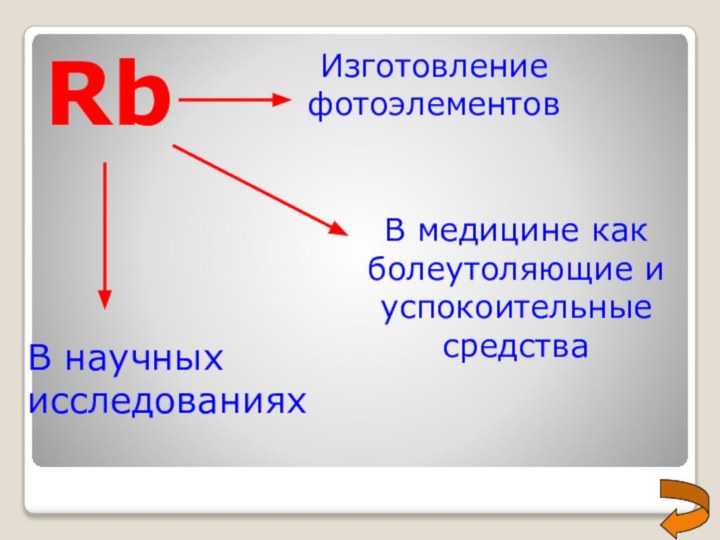
- 20. RbИзготовление фотоэлементовВ медицине как болеутоляющие и успокоительные средстваВ научных исследованиях
- 21. CsПромотор в каталитических процессахПроизводство приборов радиационного контроляПроизводство специальных стекол
- 22. Сподуменн
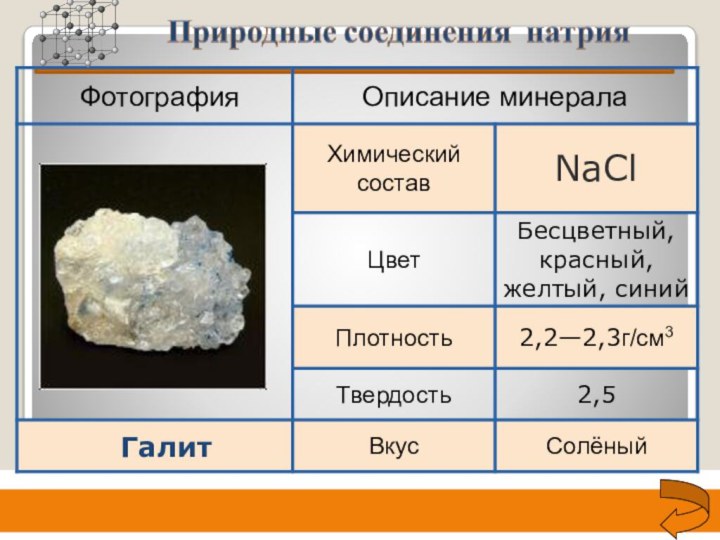
- 23. Галит
- 24. Природные соединения калияСильвин
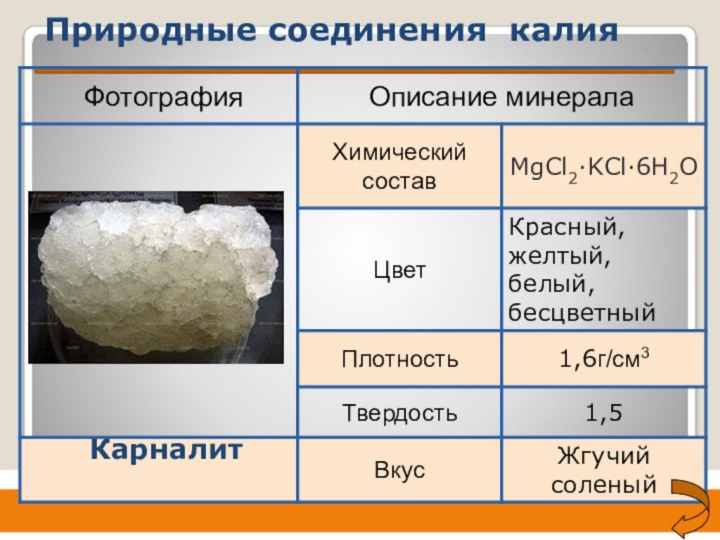
- 25. Природные соединения калияКарналит
- 26. Скачать презентацию
- 27. Похожие презентации


![Презентация к уроку химии для 9 класса по теме Щелочные металлы ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ LiNaKRbCsFr7233985133[223]2s13s14s15s16s17s1)))))))))))))))))))))))))))увеличиваютсяувеличиваютсяэлементАrВалентные электроныАтомный радиусМетал-лические свойстваВосстано-вительные свойствасоединенияLi2O,](/img/tmb/7/621673/d96b54782f13fcf57a9bbfb63e93c6ad-720x.jpg)
















Слайд 2
Положение в периодической системе химических элементов Д.И.Менделеева
I группа
главная подгруппа.
Слайд 3
ОБЩАЯ ХАРАКТЕРИСТИКА
ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ
Li
Na
K
Rb
Cs
Fr
7
23
39
85
133
[223]
2s1
3s1
4s1
5s1
6s1
7s1
))
)))
))))
)))))
))))))
)))))))
увеличиваются
увеличиваются
элемент
Аr
Валентные
электроны
Атомный радиус
Метал-лические свойства
Восстано-вительные свойства
соединения
Li2O, LiOH
основные свойства
Na2O, NaOH
основные свойства
K2O, KOH
основные
свойстваRb2O, RbOH
основные свойства
Cs2O, CsOH
основные свойства
Радиоактивный
элемент
Слайд 4
ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ
МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Твердые вещества серебристо-белого
цвета
Электропроводны и теплопроводны
Легкоплавкие. пластичные
Слайд 5
Щелочные металлы – простые вещества
Литий
Натрий
Литий и натрий -
мягкие щелочные металлы серебристо-белого цвета
Натрий – мягкий металл, его
можно резать ножом.
Слайд 8
Франций
Франций - щелочной металл, обладающий как радиоактивностью, так
и высокой химической активностью . Не имеет стабильных изотопов
Франций-223
(самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов Уран(235),
из которого поучают франций
Слайд 9
Химические свойства
щелочных металлов
Типичные металлы, очень сильные восстановители.
В соединениях проявляют единственную степень окисления +1. Восстановительная способность
увеличивается с ростом атомной массы. Взаимодействуют с водой с образованием гидроксидов (R–OH) щёлочей.Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
Слайд 10
Химические свойства
2Na + Cl2 =
2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются)
4Li + O2 = 2Li2O 2Na + O2 = Na2O2 K + O2 = KO2
оксид Li пероксид Na надпероксид K
3) 2Na + Н2 = 2NaН (при нагревании 200-400oC)
4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
Слайд 11
Образование оксидов
Оксид лития образуется при реакции лития с
кислородом:
4Li + O2=2Li2O (t)
Образование остальных оксидов рассмотрим на примере
натрия:I 2Na + O2 = Na2O2 (пероксид Na–O–О–Na)
II 2Na + Na2O2 = 2Na2O (t)
I – активная стадия
II – прокаливание
Также образуются разложением солей (карбонатов и сульфитов) кислородосодержащих кислот с соответствующими металлами:
K2CO3 K2O + CO2 Li2SO3 Li2O + SO2 (t)
Слайд 12
Гидроксиды
KOH – едкое кали
NaOH – едкий натр, каустическая
сода, каустик
Образование гидроксидов
K2O + H2O= 2KOH
Гидроксиды щелочных металлов, кроме
Li, термостойки и не разрушаются от температуры.Гидроксиды реагируют с
Кислотами
2KOH + H2SO4 = K2SO4 + 2H2O
Кислотными оксидами
2KOH + SO3 = K2SO4 + 2H2O
Солями (если образуется нерастворимое основание).
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
Слайд 13
Качественное определение щелочных металлов
Li+
Na+ K+Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ фиолетово-синий
Na+ - желтый Rb + - красный
Слайд 14
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме
+ Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление
оксидов и гидроксидов щелочных металлов:2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Получение щелочных металлов
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl.
Схема электролизера для получения натрия
Слайд 16
БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ
СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ
ответ
ответ
ответ
NaCl
Кристалли-ческая
сода
Na2CO3*10H2O
Питьевая сода
NaHCO3
поташ
K2CO3
Калийная селитра
KNO3
Глауберова соль
Na2SO4*10H2O
Слайд 17
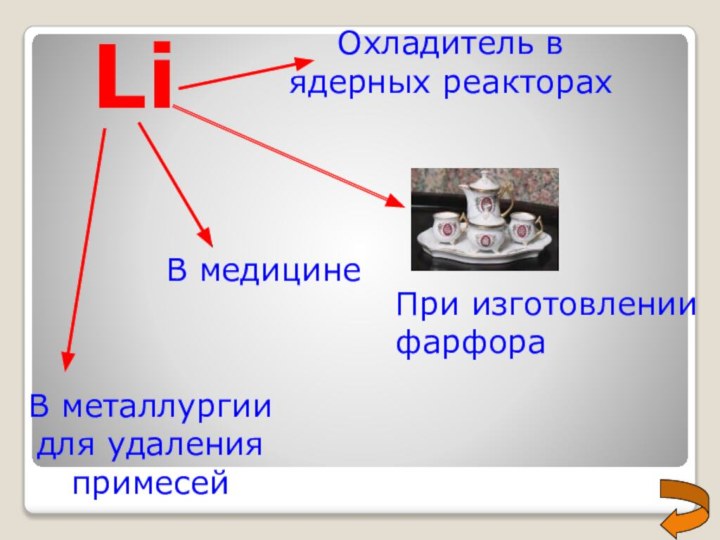
Li
Охладитель в ядерных
реакторах
В медицине
В металлургии для удаления примесей
При изготовлении фарфора
Слайд 18
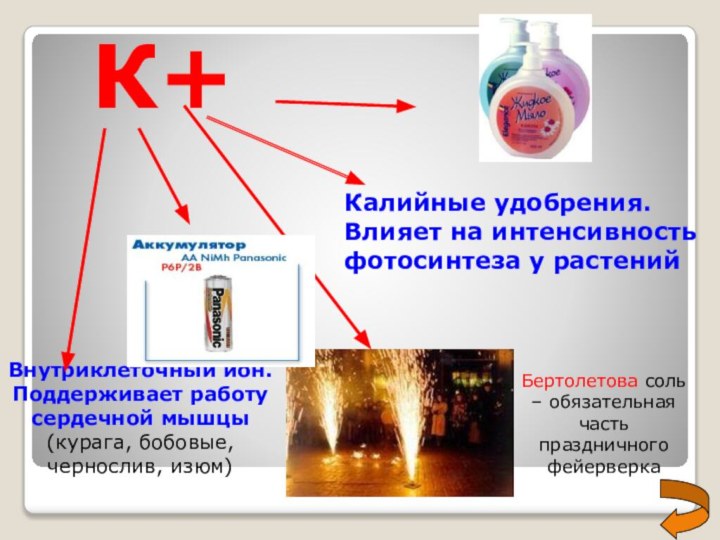
К+
Внутриклеточный ион. Поддерживает
работу сердечной мышцы (курага, бобовые, чернослив, изюм)
Калийные удобрения. Влияет
на интенсивность фотосинтеза у растенийБертолетова соль – обязательная часть праздничного фейерверка