CH3
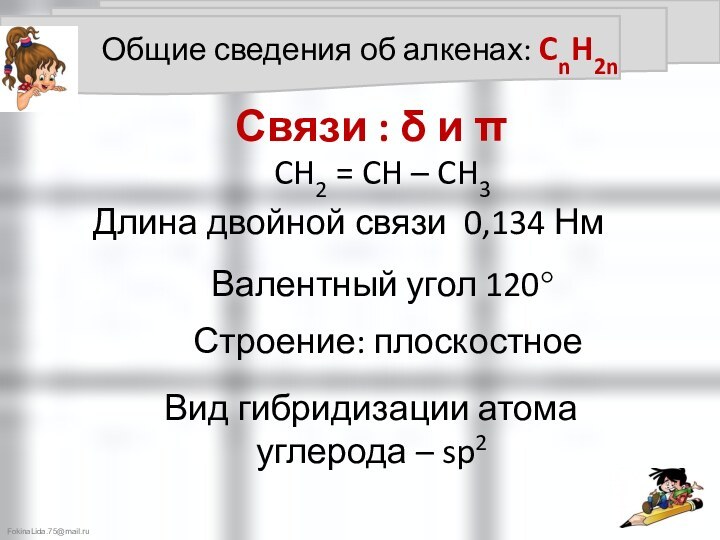
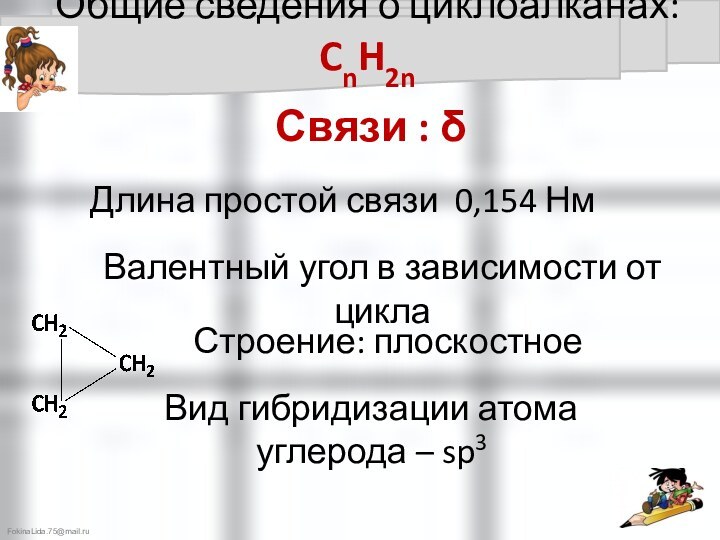
Все связи – простые - δ - связи
Длина простой
связи 0,154 НмВалентный угол 109°28'
Строение: пространственное - тетраэдрическое
Вид гибридизации атома
углерода – sp3
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









![Презентация по теме: Обобщение сведений об углеводородах (11 класс) 6) Алкен + [О] + Н2О → двухатомный спирт (окисление в нейтральной](/img/tmb/7/623399/0aacad707318bebddd360043b97460d5-720x.jpg)








![Презентация по теме: Обобщение сведений об углеводородах (11 класс) CH≡C – CH3 + HOH → [CH2 = C – CH3 ]](/img/tmb/7/623399/eb543bf894ef4c2fe574261f5a996468-720x.jpg)




![Презентация по теме: Обобщение сведений об углеводородах (11 класс) СH2=CH–CH=CH2 + H2[CH2–CH–CH–CH2] | | |](/img/tmb/7/623399/f6a7a2532bcbb84ad7cd5bfb1d4b9313-720x.jpg)

![Презентация по теме: Обобщение сведений об углеводородах (11 класс) СH2=CH‒CH=CH2 + Br2[CH2–CH–CH–CH2] | | |](/img/tmb/7/623399/9e817dfcfb97531e8d83ff525311729e-720x.jpg)


![Презентация по теме: Обобщение сведений об углеводородах (11 класс) СH2=CH-CH=CH2 + HBr[CH3–CH–CH–CH2] | |](/img/tmb/7/623399/4de43330f70c04f818af54f3cecc53ce-720x.jpg)
















![Презентация по теме: Обобщение сведений об углеводородах (11 класс) Реакции окисления других гомологов + 5 [O] →+ RCOOH + H2OБензойная кислотаКарбоновая кислота+](/img/tmb/7/623399/d46779584e96c736b3fe5280af9a38b9-720x.jpg)





Валентный угол 109°28'
Строение: пространственное - тетраэдрическое
Вид гибридизации атома
углерода – sp3
AlCl3 t°
CH3 – CH2 – CH3 + Cl2 → CH3 – CH – CH3 + HCl
|
Cl
hυ
CH3 – CH2 –CH2 – CH3 → CH3 – CH – CH3
|
CH3
AlCl3
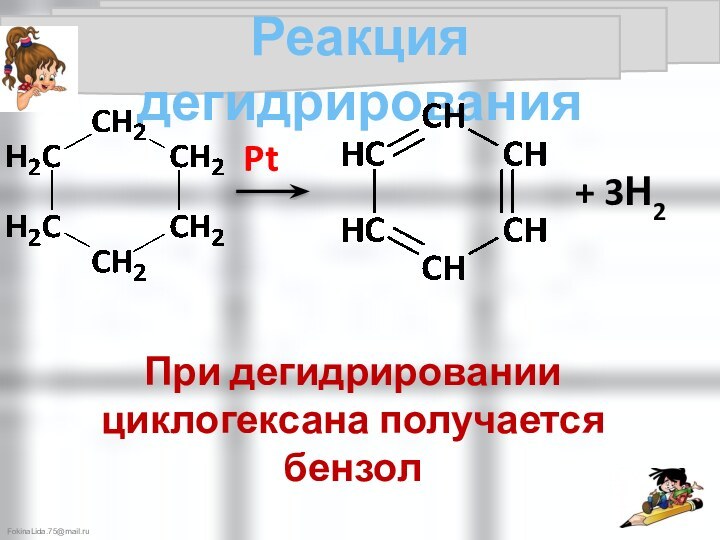
5). Алкан → арен + Н2
(реакция риформинга)
Cr2O3, t°
Химические свойства алканов: CnH2n+2
CH3 – CH3 → CH2 = CH2 + H2
C16H34 → C8H18 + C8H16
t°
Cr2O3, t°
t°, kat
Метан
→ С + Н2 (пиролиз или термическое
разложение)
t°
t°, kat
Строение: плоскостное
Вид гибридизации атома
углерода – sp2
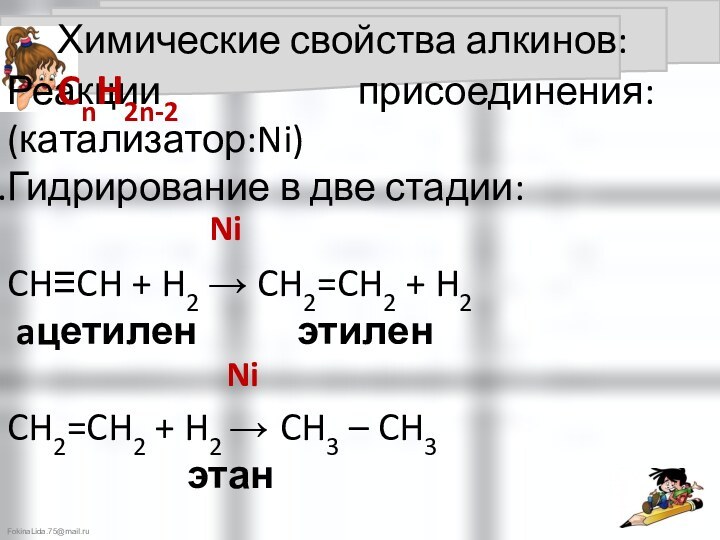
t°, Ni
t°, Ni
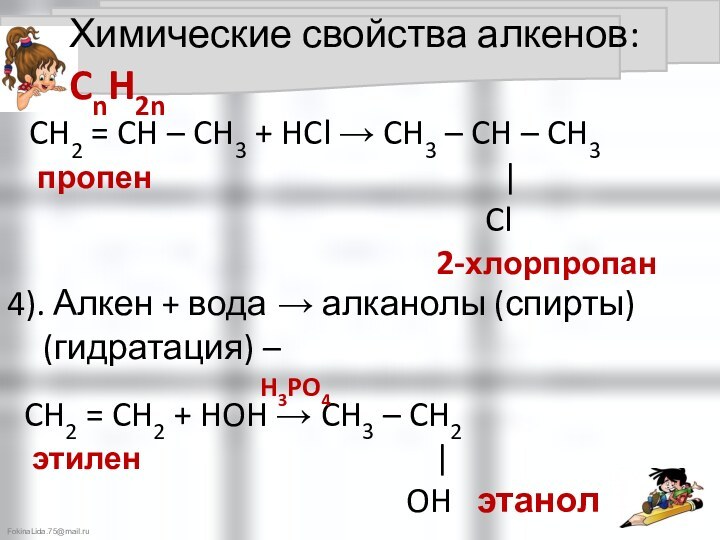
2). Алкен + галоген → дигалогеналкан (галогенирование)
CH2 = CH2 + Cl2 → CH2 – CH2
этилен | |
Cl Cl 1,2-дихлорэтан
CH2 = CH2 + HCl → CH3 – CH2
этилен |
Cl хлорэтан
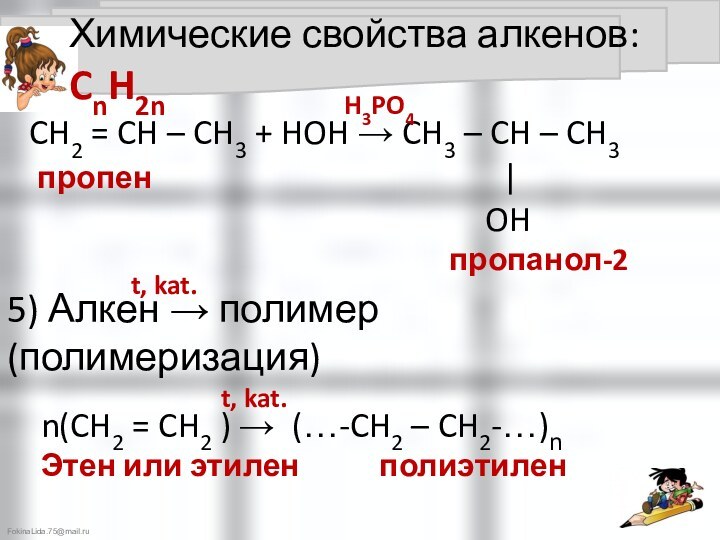
4). Алкен + вода → алканолы (спирты) (гидратация) –
CH2 = CH2 + HOH → CH3 – CH2
этилен |
OH этанол
H3PO4
H3PO4
5) Алкен → полимер (полимеризация)
t, kat.
n(CH2 = CH2 ) → (…-CH2 – CH2-…)n
Этен или этилен полиэтилен
t, kat.
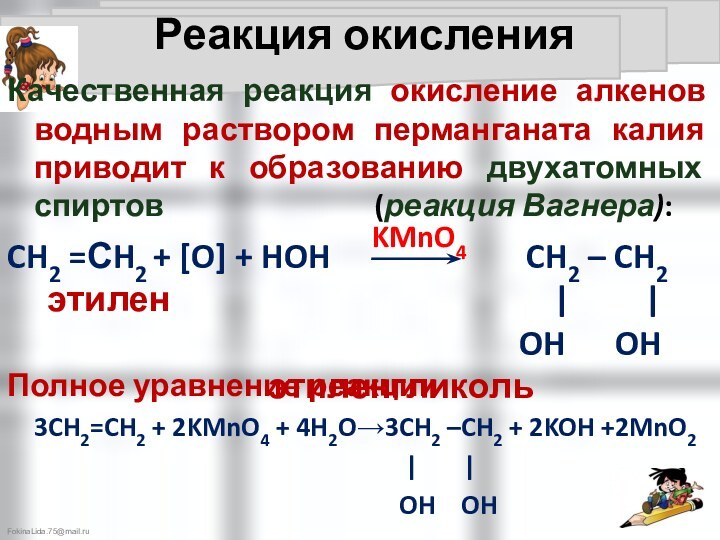
Химические свойства алкенов: CnH2n
:
CH2 =СH2 + [O] + HOH CH2 – CH2
этилен | |
OH OH этиленгликоль
KMnO4
CuCl2
Химические свойства алкенов: CnH2n
Вид гибридизации атома
углерода – sp3
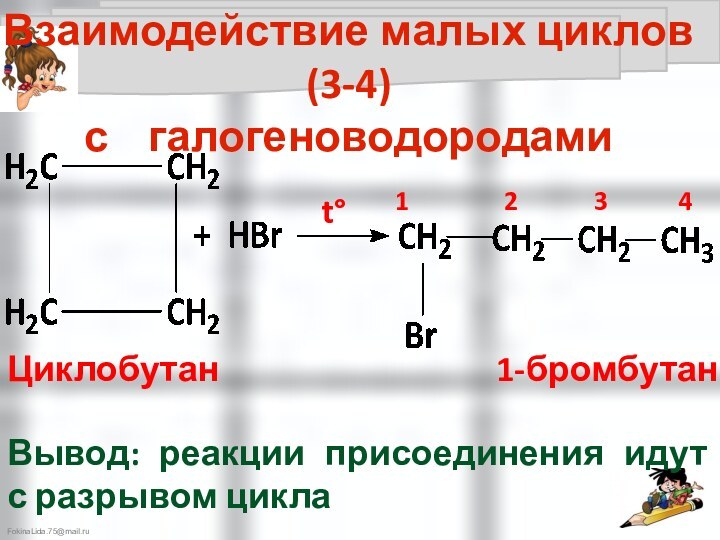
Циклобутан бутан
80°С, Ni
120°С, Ni
Циклобутан 1,4-дихлорбутан
1 2 3 4
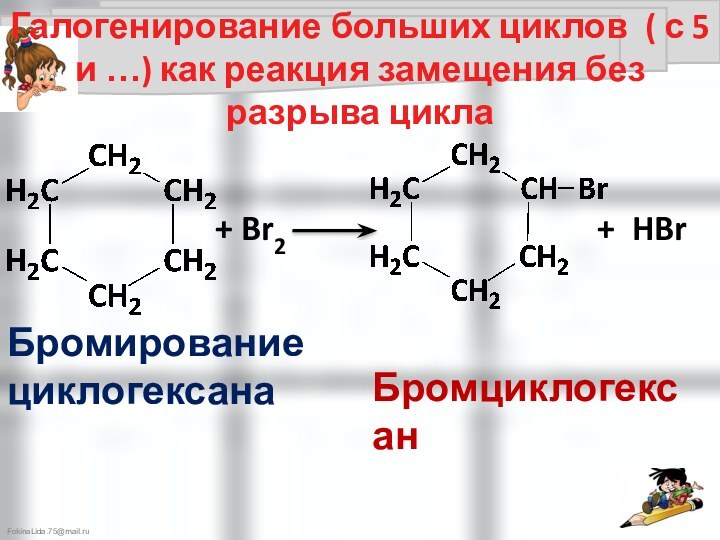
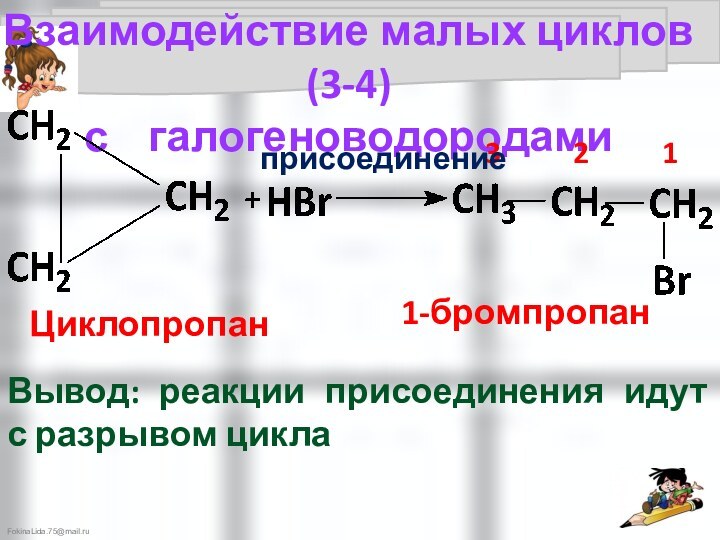
Галогенирование малых циклов идёт как реакция присоединения с разрывом цикла
1-бромпропан
1 2 3 4
t°
Вывод: реакции присоединения идут с разрывом цикла
Взаимодействие малых циклов (3-4)
с галогеноводородами
Общие сведения об алкинах: CnH2n-2
Ni
Ni
Химические свойства алкинов: CnH2n-2
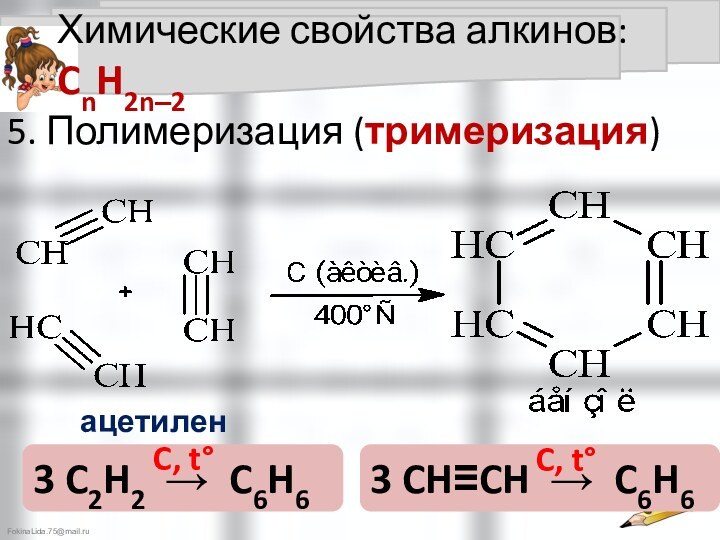
Химические свойства алкинов: CnH2n‒2
Химические свойства алкинов: CnH2n‒2
HgSO4, H+
Этаналь –
альдегид
ацетилен
O
//
CH3 – C
\
H
HgSO4, H+
→ СH3 – C – CH3
ǁ
O
Пропанон (ацетон) относится к классу кетонов
4. Гидратация гомологов ацетилена – взаимодействие с водой ведёт к образованию кетонов
(реакция Кучерова)
CuCl, t° 80
CH≡C ‒ CH=CH2 + HCl → CH2= C ‒ CH=CH2
|
Cl
хлоропрен
Химические свойства алкинов: CnH2n‒2
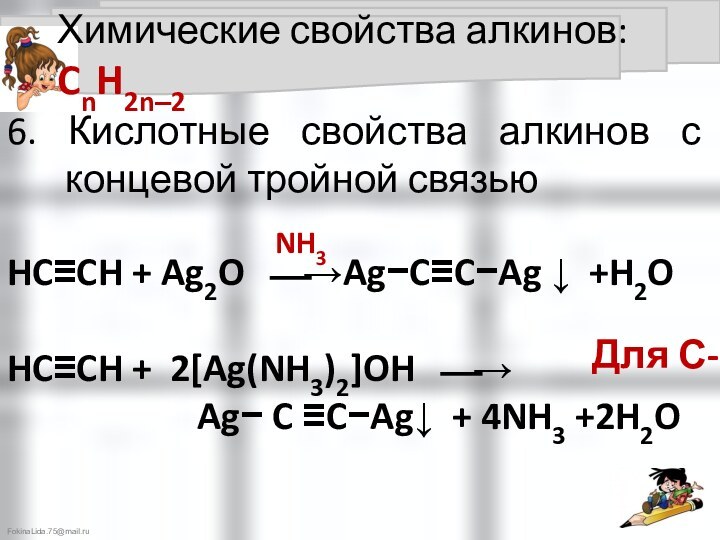
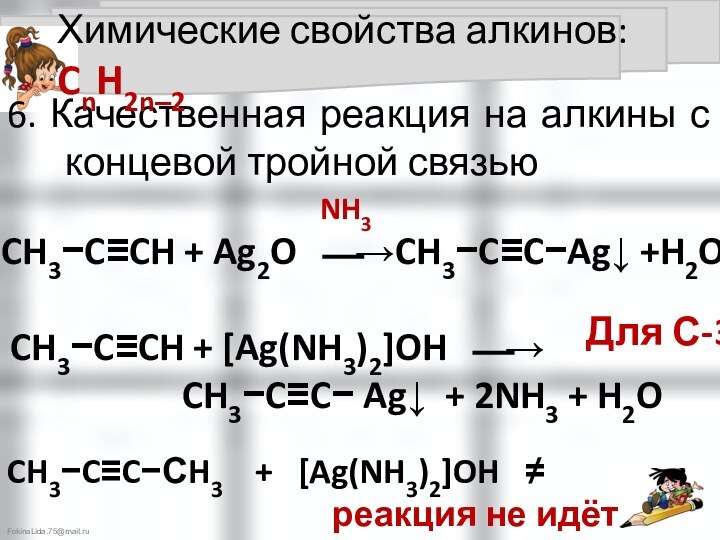
6. Кислотные свойства алкинов с концевой тройной связью
Химические свойства алкинов: CnH2n‒2
NH3
Для С-3
Химические свойства алкинов: CnH2n‒2
CH3−C≡C−СH3 + [Ag(NH3)2]OH ≠
реакция не идёт
Химические свойства алкинов: CnH2n‒2
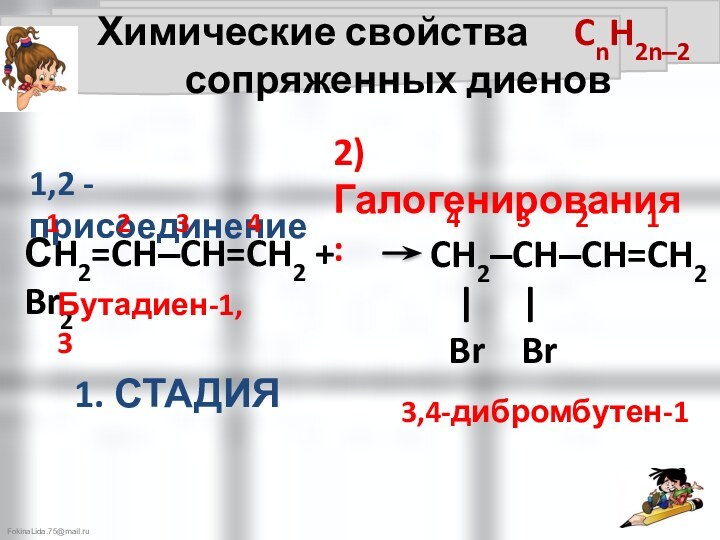
Общие сведения об алкадиенах: CnH2n-2
Ni,t°
Бутадиен-1,3 бутен-1
4 3 2 1
CH3–CH2–CH=CH2 + Н2
Ni,t°
CH3–CH2–CH2–CH3
Бутен-1 бутан
1. СТАДИЯ
2. СТАДИЯ
1) Гидрирования:
1,4 - присоединение
1 2 3 4
Ni,t°
бутен-2
4 3 2 1
CH3–CH=CH–CH3
1. СТАДИЯ
Химические свойства CnH2n‒2
сопряженных диенов
Ni,t°
бутен-2
4 3 2 1
CH3-CH=CH–CH3 + H2
2. СТАДИЯ
бутан
Химические свойства CnH2n‒2
сопряженных диенов
Бутадиен-1,3
4 3 2 1
3,4-дибромбутен-1
1. СТАДИЯ
Химические свойства CnH2n‒2
сопряженных диенов
3,4-дибромбутен-1
CH2–CH–CH–CH2
| | | |
Br Br Br Br
2. СТАДИЯ
1,2,3,4-тетрабромбутан
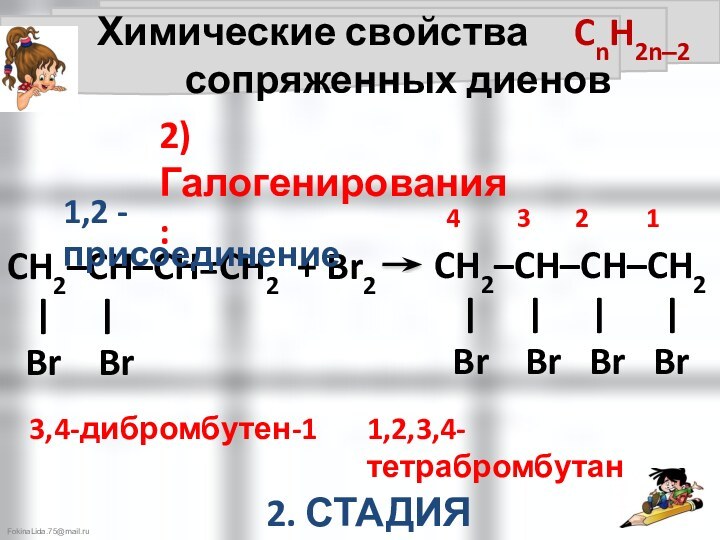
Химические свойства CnH2n‒2
сопряженных диенов
2) Галогенирования:
1,4 - присоединение
1 2 3 4
4 3 2 1
CH2‒CH=CH–CH2
| |
Br Br
1 2 3 4
1,4-дибромбутен-2
1. СТАДИЯ
Химические свойства CnH2n‒2
сопряженных диенов
2) Галогенирования:
1,4 - присоединение
4 3 2 1
CH2–CH=CH–CH2 + Br2
| |
Br Br
1 2 3 4
1,2,3,4- тетрабромбутан
2. СТАДИЯ
1,4-дибромбутен-2
Химические свойства CnH2n‒2
сопряженных диенов
Бутадиен-1,3
4 3 2 1
3-бромбутен-1
1. СТАДИЯ
Правило Марковникова!
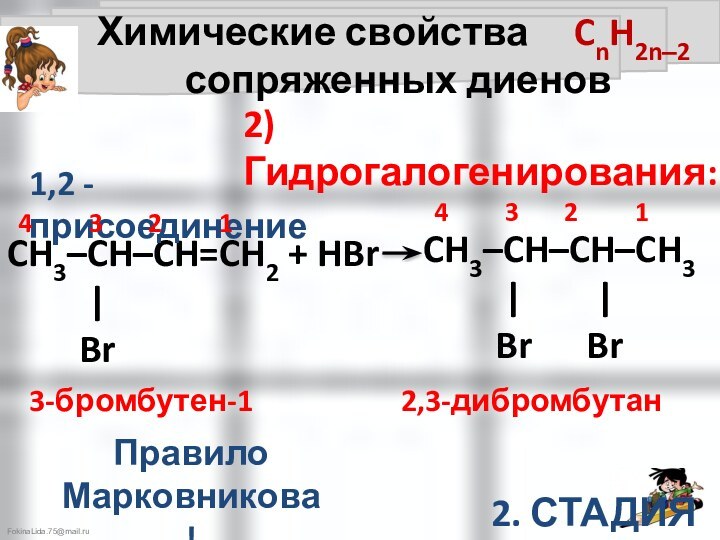
Химические свойства CnH2n‒2
сопряженных диенов
4 3 2 1
2,3-дибромбутан
2. СТАДИЯ
CH3–CH–CH–CH3
| |
Br Br
3-бромбутен-1
Правило Марковникова!
Химические свойства CnH2n‒2
сопряженных диенов
2) Гидрогалогенирования:
1,4 - присоединение
1 2 3 4
4 3 2 1
CH3-CH=CH–CH2
|
Br
4 3 2 1
1- бромбутен-2
1. СТАДИЯ
Химические свойства CnH2n‒2
сопряженных диенов
CH3-CH=CH–CH2 + HBr
|
Br
4 3 2 1
1,2- дибромбутан
2. СТАДИЯ
CH3-CH2–CH–CH2
| |
Br Br
1- бромбутен-2
Химические свойства CnH2n‒2
сопряженных диенов
Общие сведения об аренах: CnH2n-6
C6H6
Общие сведения об аренах: CnH2n-6
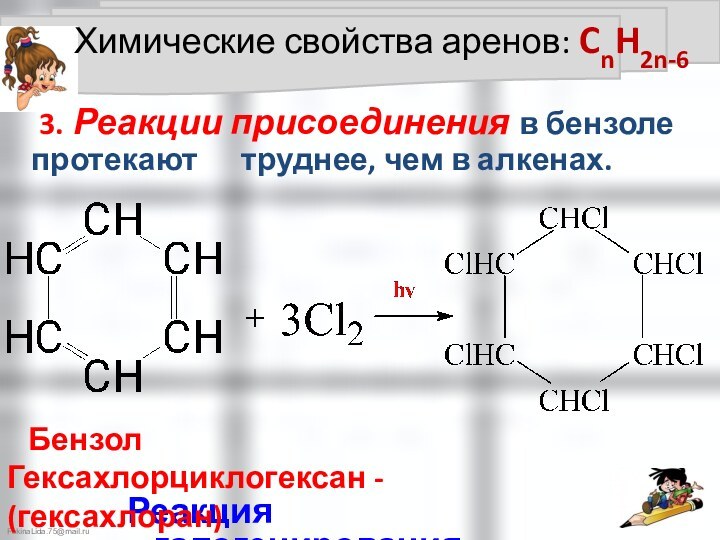
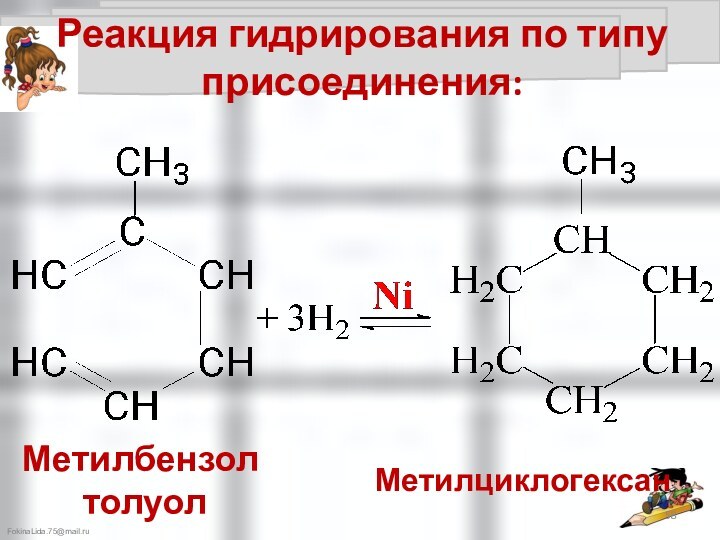
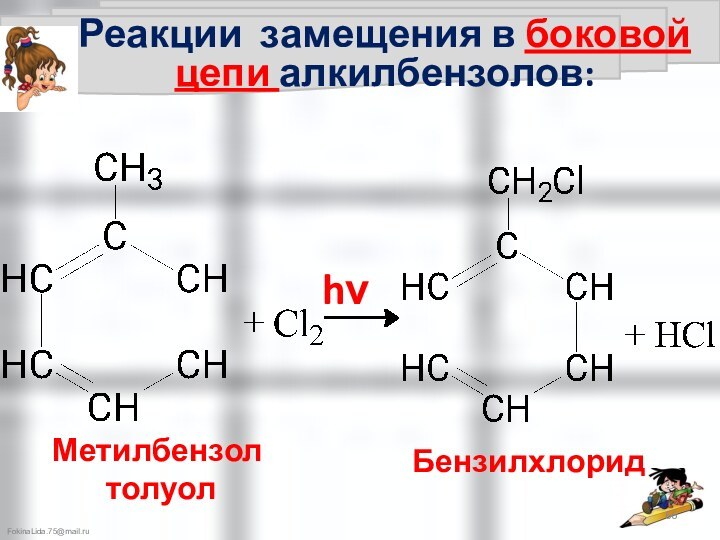
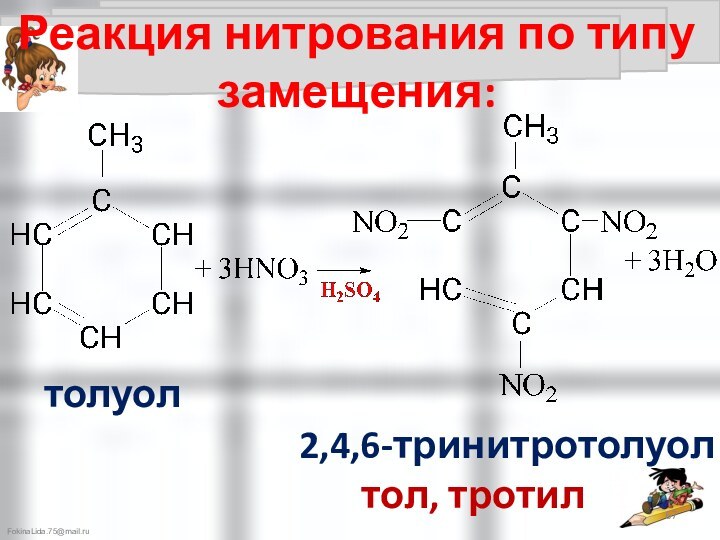
Химические свойства аренов: CnH2n-6
Химические свойства аренов: CnH2n-6
Химические свойства аренов: CnH2n-6
Химические свойства аренов: CnH2n-6
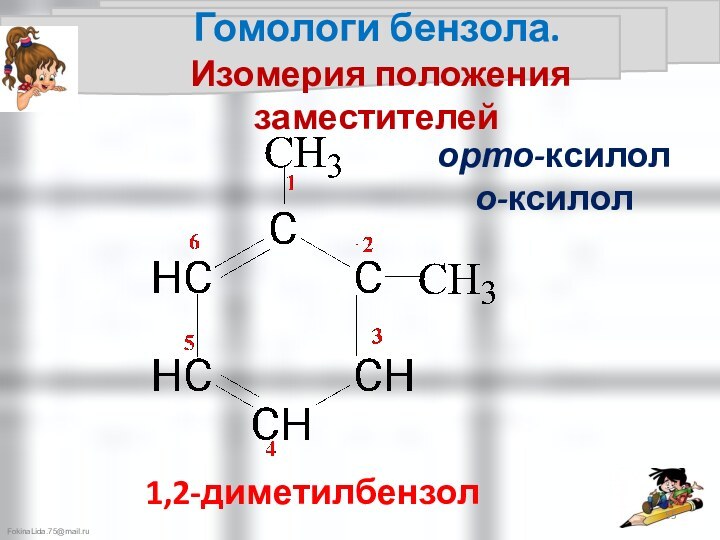
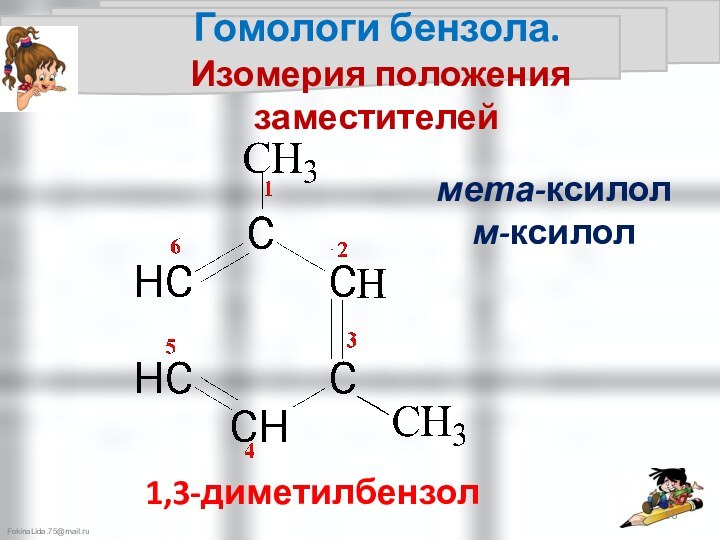
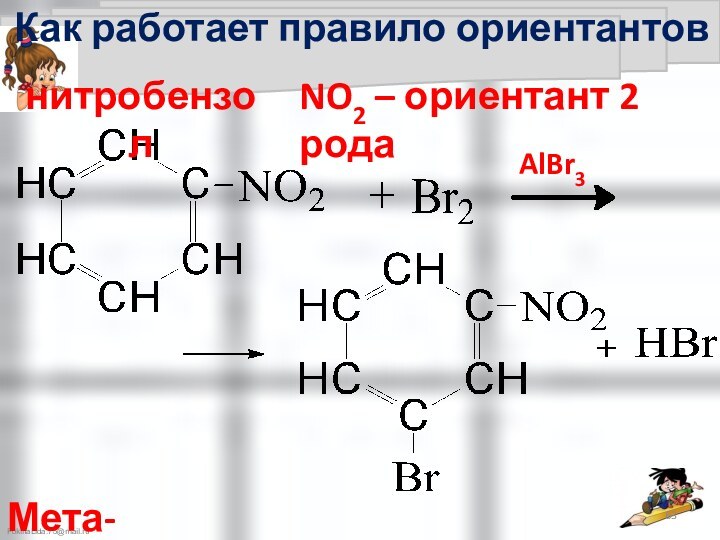
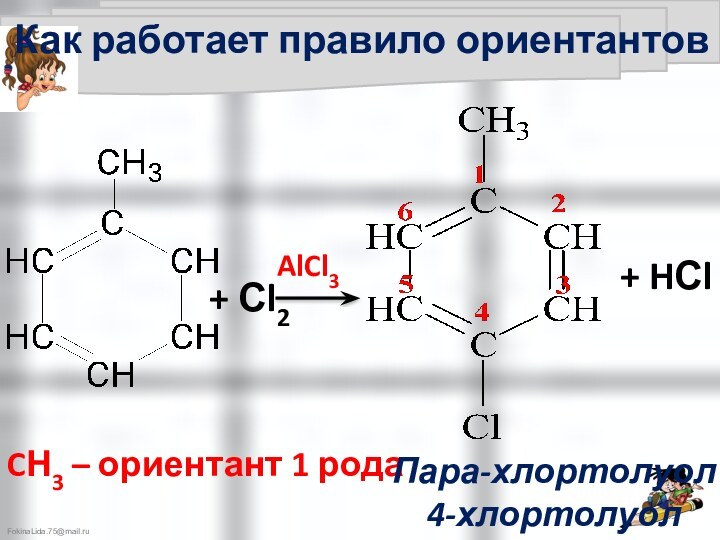
Правила ориентации
в бензольном кольце
Правила ориентации в бензольном кольце
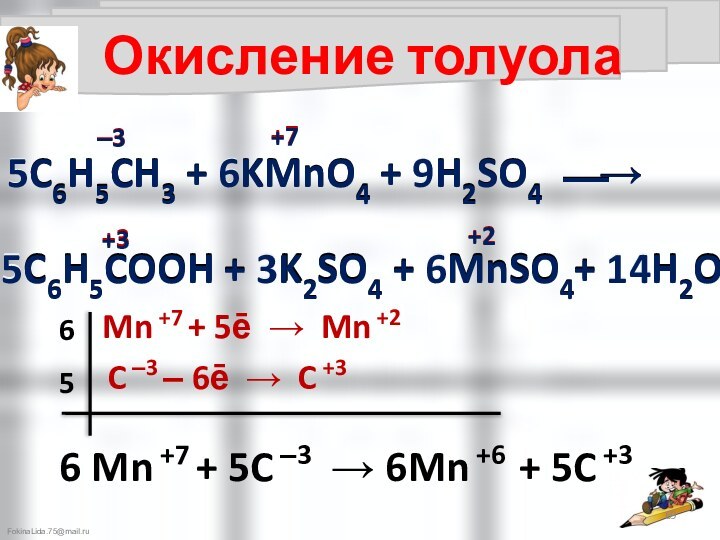
C ‒3 ‒ 6ē → C +3
6
6 Mn +7 + 5C ‒3 → 6Mn +6 + 5C +3
5
5C6H5CH3 + 6KMnO4 + 9H2SO4 ⎯→
5C6H5COOH + 3K2SO4 + 6MnSO4+ 14H2O
‒3
+7
+3
+2
-2
-3
+7
+3
+4
+2
Mn +7 + 5ē → Mn +2
C ‒2 ‒ 5ē → C +3
C ‒3 ‒ 7ē → C +4
12
5
5
12 Mn +7 + 5C ‒2 + 5C ‒3 → 12Mn +2 + 5C +3 + 5C +4
Окисление этилбензола перманганатом калия в кислой среде
5C6H5CH2 − СН3 + 12KMnO4 + 18H2SO4 →
5С6H5COOH+ 5СО2+ 12MnSO4 + 6K2SO4 + 28H2O
C ‒2 ‒ 6ē → C +4
2
2 Mn +7 + C ‒1 + C ‒2 → 2Mn +2 + C +3 + C +4
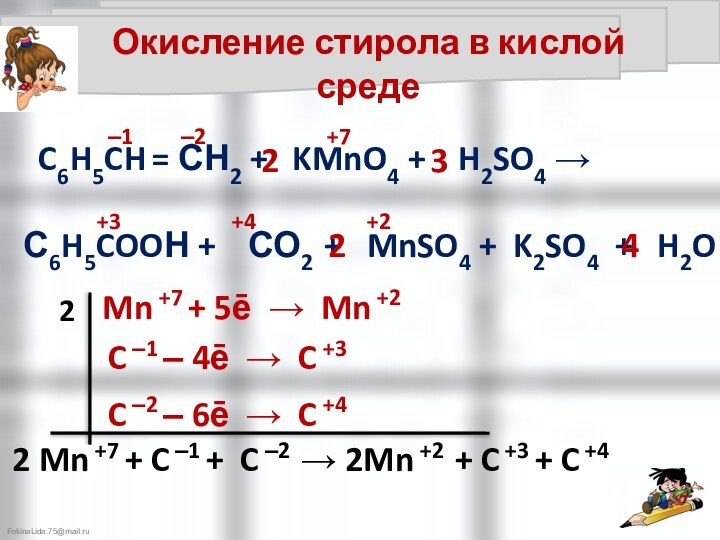
C6H5CH = СН2 + KMnO4 + H2SO4 →
С6H5COOН + СО2 + MnSO4 + K2SO4 + H2O
Окисление стирола в кислой среде
2
2
3
4
‒3
+7
+3
+6
Mn +7 + 1ē → Mn +6
C ‒3 ‒ 6ē → C +3
6
6 Mn +7 + C ‒3 → 6Mn +6 + C +3
6
6
7
5
‒2
+7
+3
+6
Mn +7 + 1ē → Mn +6
C ‒2 ‒ 5ē → C +3
12
12Mn +7 + C ‒2 + C ‒3 → 12Mn +6 + C +3 + C +4
12
15
12
10
‒3
+4
C ‒3 ‒ 7ē → C +4
‒1
‒2
+7
+3
+4
+6
Mn +7 + 1ē → Mn +6
C ‒1 ‒ 4ē → C +3
C ‒2 ‒ 6ē → C +4
10
10 Mn +7 + C ‒1 + C ‒2 → 10Mn +6 + C +3 + C +4
10
10
13
8