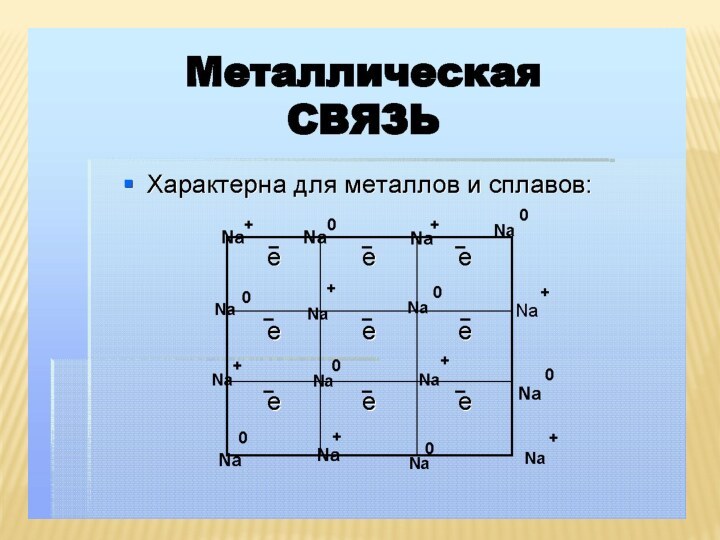
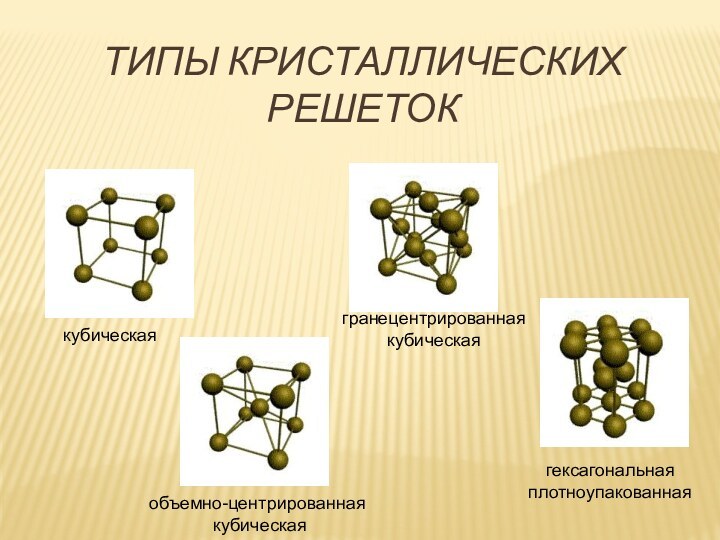
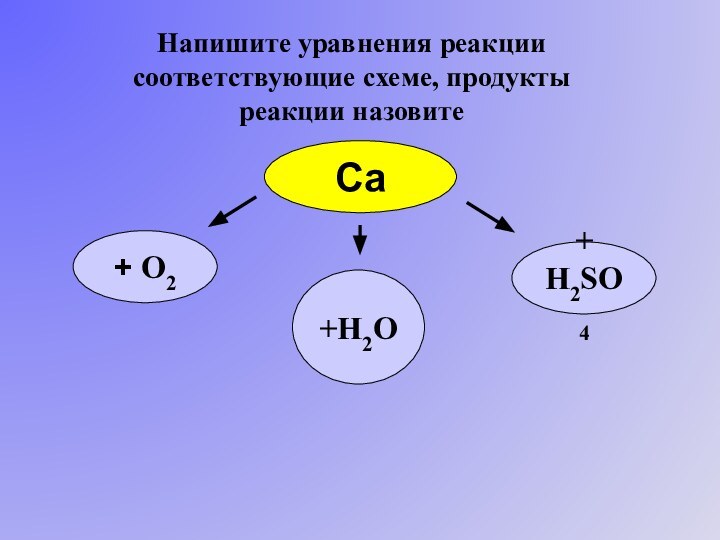
множество ядер, связь делаколизована;
валентные электроны свободно перемещаются
по всему куску металла, который в целом электронейтрален;металлическая связь не обладает направляемостью и насыщенностью.
Характеристика металлической связи