- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ГИДРОЛИЗ 9 класс
Содержание
- 2. СОДЕРЖАНИЕОпределениеТипы солей,участвующих в гидролизеАлгоритм составления уравнений гидролизаПрименение гидролизаПримеры солей,участвующих в гидролизеВопросы для самоконтроляОбратите внимание!
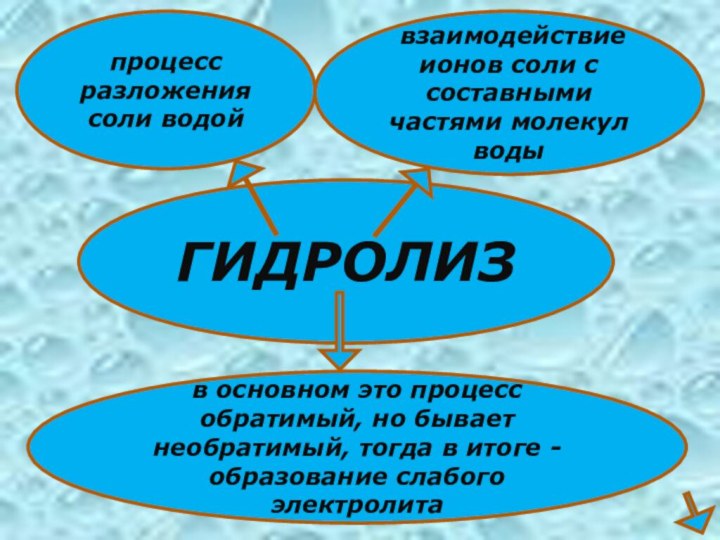
- 3. ГИДРОЛИЗпроцесс разложения соли водой взаимодействие ионов соли
- 4. Новые понятияГидролиз – реакция обмена между растворимыми
- 5. Соль образована сильным основанием и сильной кислотойСоль
- 6. ALCL3AL3++3CL-AL(OH)3(слабое основание)HCL(сильная кислота)AL3+ + H2O H+
- 7. О Б Р А Т И Т Е В Н И М А Н И Е:!!
- 8. Гидролизу НЕ подвергаютсякатионы сильных основанийNa+K+Ca2+анионы сильных кислотCL-SO42-NO3-Ba2+Li +Sr2+Rb+Cs+CLO4 -Br -I -
- 9. Гидролизу подвергаются катионыслабого основания, например:AL3+Fe3+Cu2+анионы слабой кислоты, например:CO32-SO32-S2-NO2-PO43-Cr3+Fe2+Hg2+
- 10. Классификация солейЗадание1. Разделите предложенные формулы солей на четыре
- 11. Алгоритм составления уравнений гидролизаПроверить растворимость соли.Определить состав
- 12. П Р И М Е Р Ы
- 13. CuCL2Cu(OH)2-слабоеоснованиеHCL(сильнаякислота) Cu2+ + 2CL- H+OH-Cu2+ +
- 14. Соли, образованные слабым основанием и сильной кислотойФенолфталеин+ CuCl2+ CuCl2+ CuCl2лакмусМетил-оранж
- 15. 2Na++ S2- NaOH(сильноеоснование)H2S(слабая)кислотаS2- +HOH
- 16. Соли, образованные сильным основанием и слабой кислотой+Na2S+Na2S+Na2SлакмусМетил-оранжФенолфталеин
- 17. KCLHCL (сильная кислота)KOH (сильное основание)гидролизу не подвергаетсясреда растворанейтральнаяГидролиз хлорида калия
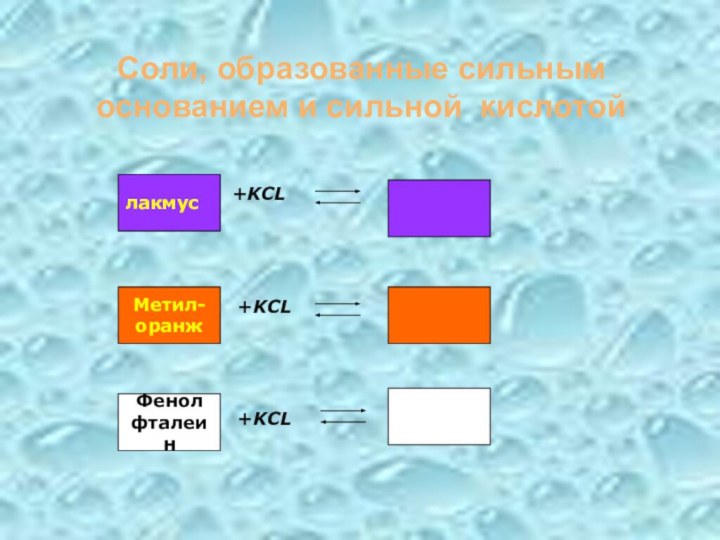
- 18. Соли, образованные сильным основанием и сильной кислотой+KCL+KCL+KCLлакмусМетил-оранжФенолфталеин
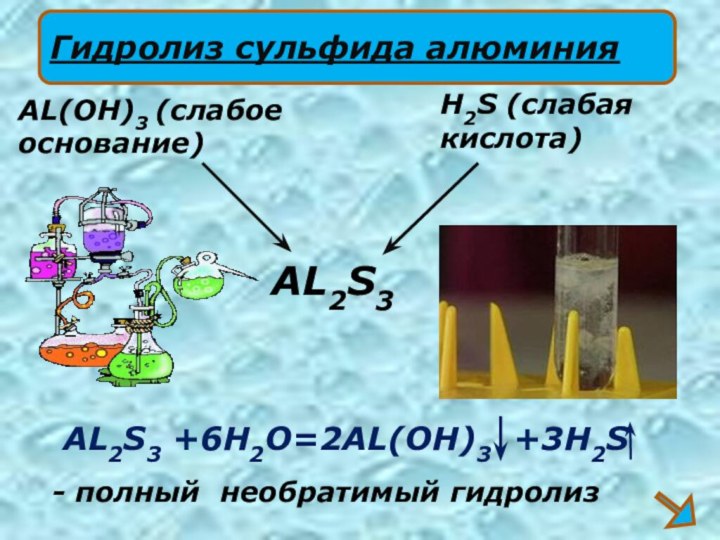
- 19. AL2S3 +6H2O=2AL(OH)3 +3H2SAL2S3H2S (слабаякислота)AL(OH)3 (слабое основание)Гидролиз сульфида алюминия- полный необратимый гидролиз
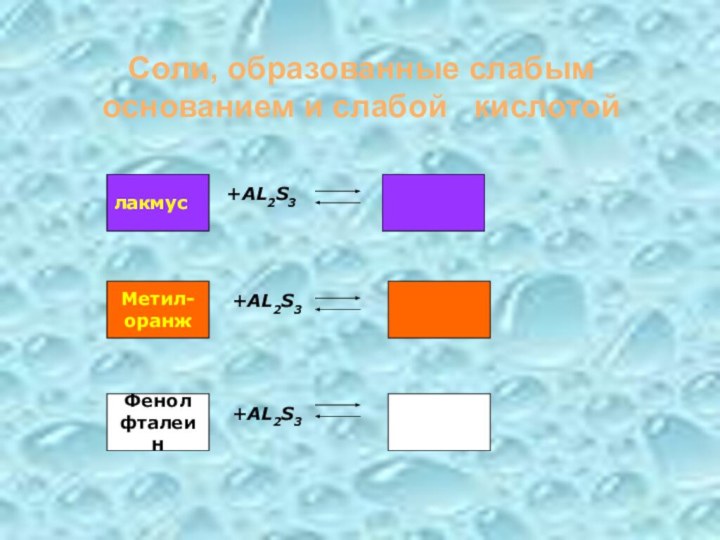
- 20. Соли, образованные слабым основанием и слабой кислотой+AL2S3+AL2S3+AL2S3лакмусМетил-оранжФенолфталеин
- 21. стиркамытьепосудыумываниес мыломРоль гидролиза в повседневной жизни человека
- 22. Для умывания, стирки, мытья посуды нужны синтетические
- 23. А ТЕПЕРЬ ВОПРОСЫ….
- 24. Нейтральную среду имеет водный раствор: 1)нитрита натрия 2)силиката калия 3)хлорида железа (II) 4)нитрата калияНайди верный ответ
- 25. В водном растворе какой соли фенолфталеин окрашен в малиновый цвет? 1)CaCl22)KNO33)FeSO44)Na2CO3Найди верный ответ
- 26. Одинаковую реакцию среды имеют растворы карбоната натрия
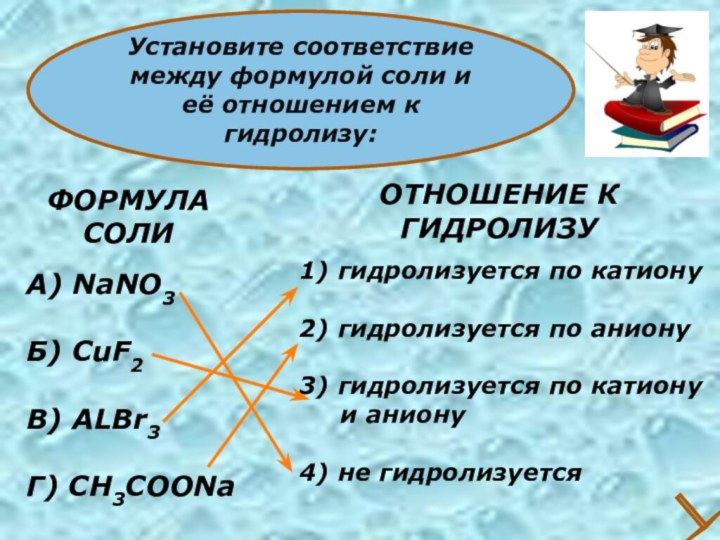
- 27. ФОРМУЛА СОЛИА) NaNO3Б) CuF2В) ALBr3Г) CH3COONa1) гидролизуется
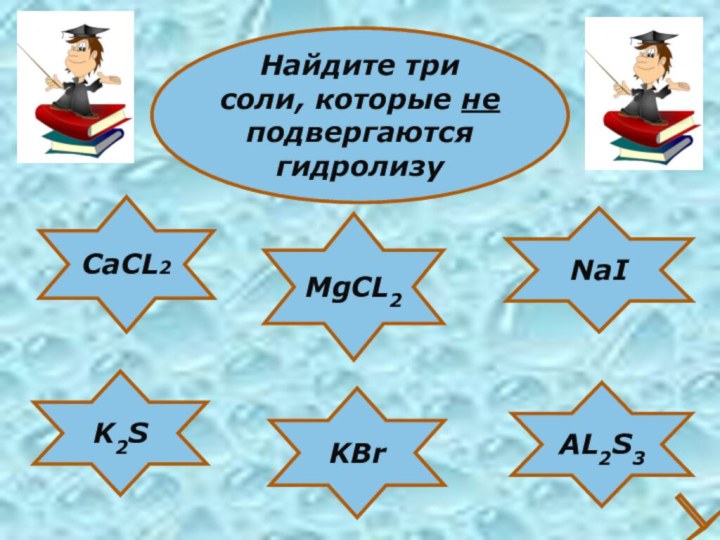
- 28. CaCL2NaIK2SKBrAL2S3MgCL2Найдите три соли, которые не подвергаютсягидролизу
- 29. Гидролиз нитрата алюминия идет по катионуГидролиз сульфата
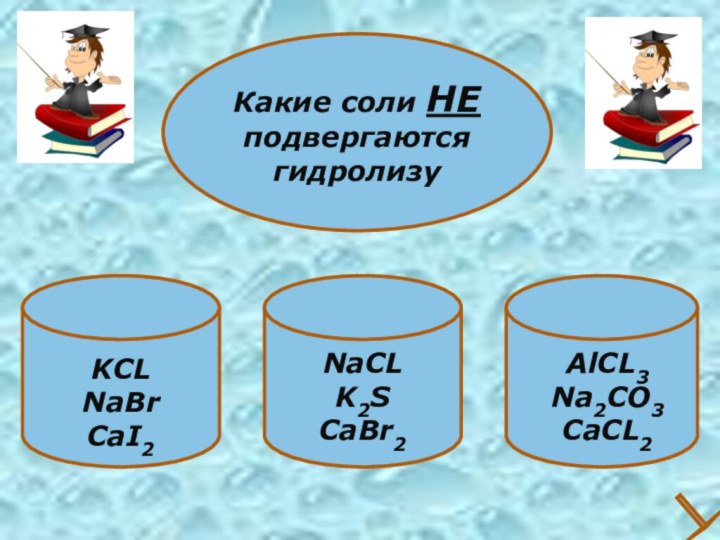
- 30. KCLNaBrCaI2Какие соли НЕ подвергаются гидролизуNaCLK2SCaBr2AlCL3Na2CO3CaCL2
- 31. Какая соль подвергается гидролизу по катиону и по анионуВаCL2KNO2Cr2S3CuI2
- 32. В Ы В О Д:Э Т О
- 33. Скачать презентацию
- 34. Похожие презентации















Слайд 2
СОДЕРЖАНИЕ
Определение
Типы солей,участвующих в гидролизе
Алгоритм составления уравнений гидролиза
Применение гидролиза
Примеры
солей,участвующих в гидролизе
Слайд 3
ГИДРОЛИЗ
процесс разложения соли водой
взаимодействие ионов соли с
составными частями молекул воды
в основном это процесс обратимый, но
бывает необратимый, тогда в итоге - образование слабого электролита
Слайд 4
Новые понятия
Гидролиз – реакция обмена между растворимыми солями
и водой
Сильные основания – сильные электролиты - щелочи (NaOH,
KOH, Ca(OH)2 и другие)Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
Слайд 5
Соль образована
сильным основанием и сильной кислотой
Соль образована
сильным основанием и слабой кислотой
Соль образована
слабым основанием и
сильной кислотойСоль образована
слабым основанием и слабой кислотой
Классификация солей
участвующих в гидролизе:
Слайд 6
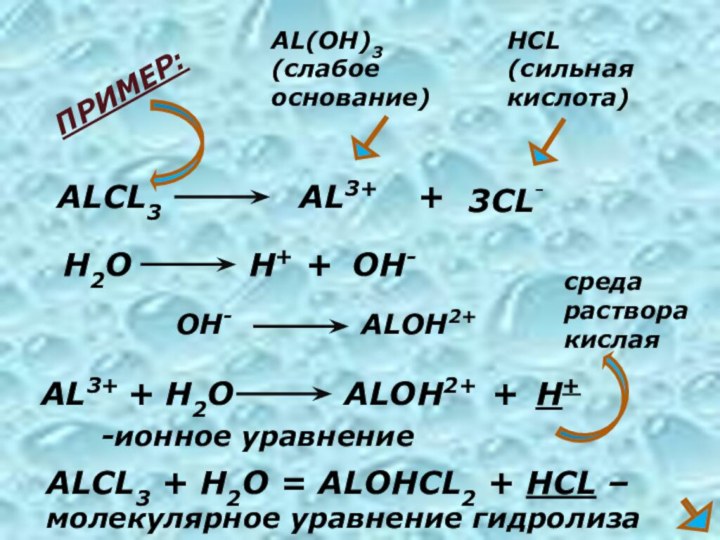
ALCL3
AL3+
+
3CL-
AL(OH)3
(слабое основание)
HCL
(сильная кислота)
AL3+ + H2O
H+
OH-
ALOH2+
H+
+
-ионное уравнение
ALCL3 + H2O = ALOHCL2
+ HCL – молекулярное уравнение гидролизаПРИМЕР:
среда
раствора
кислая
H2O
+
OH-
ALOH2+
Слайд 8
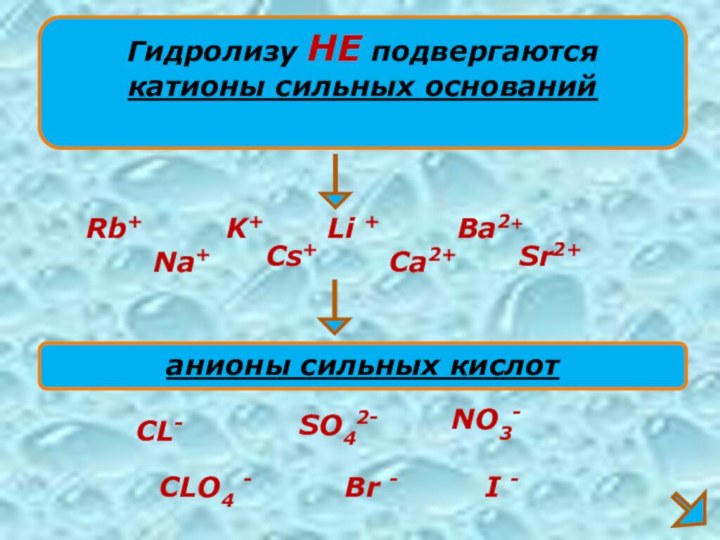
Гидролизу НЕ подвергаются
катионы сильных оснований
Na+
K+
Ca2+
анионы сильных кислот
CL-
SO42-
NO3-
Ba2+
Li +
Sr2+
Rb+
Cs+
CLO4
-
Br -
I -
Слайд 9
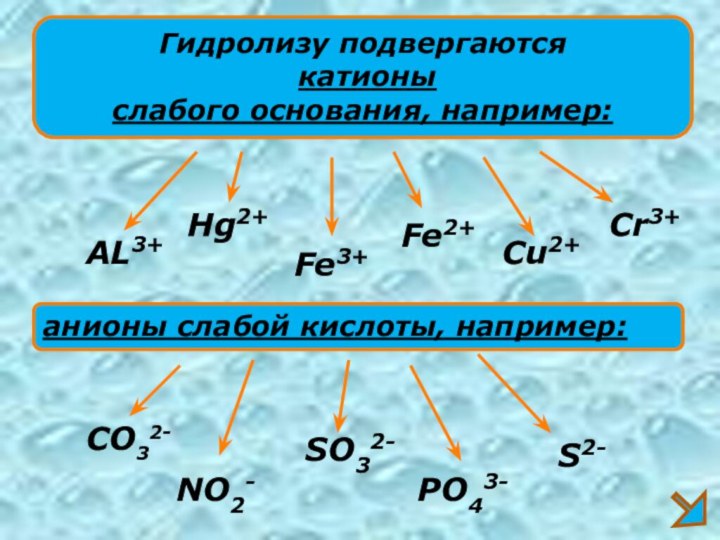
Гидролизу подвергаются
катионы
слабого основания, например:
AL3+
Fe3+
Cu2+
анионы слабой кислоты, например:
CO32-
SO32-
S2-
NO2-
PO43-
Cr3+
Fe2+
Hg2+
Слайд 10
Классификация солей
Задание1.
Разделите предложенные формулы солей на четыре типа,
объясните свой выбор:
BaCl2, ZnSO4, CuCl2, Na2SO4, Al(NO3)3, MnCl2, Cr2(SO4)3,
K2SiO3, LiNO3, Co(NO2)2,MgSO3
Слайд 11
Алгоритм составления
уравнений гидролиза
Проверить растворимость соли.
Определить состав соли,
т.е. указать, каким по силе основанием и какой по
силе кислотой образована данная сольЗаписать диссоциацию соли и подчеркнуть ион слабого электролита
Записать уравнение взаимодействия иона слабого электролита с водой
Определить среду раствора соли
Записать молекулярное уравнение
Слайд 13
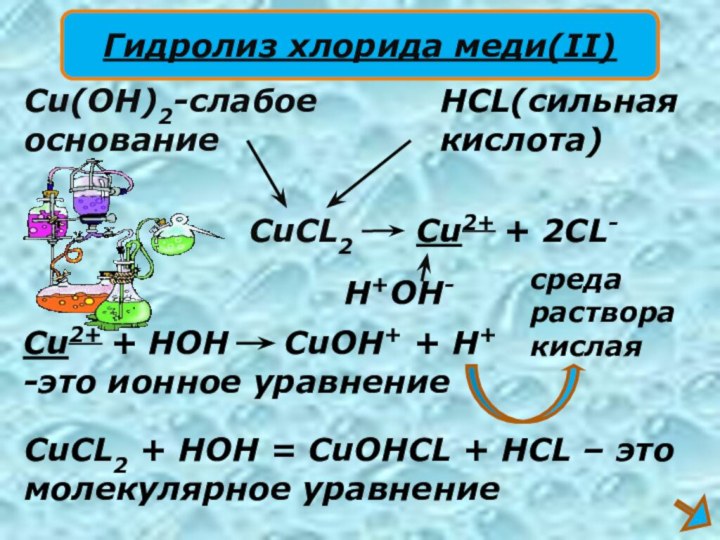
CuCL2
Cu(OH)2-слабое
основание
HCL(сильная
кислота)
Cu2+ + 2CL-
H+OH-
Cu2+ + HOH
CuOH+ + H+
-это ионное уравнение
CuCL2 + HOH
= CuOHCL + HCL – этомолекулярное уравнение
Гидролиз хлорида меди(II)
среда
раствора
кислая
Слайд 14
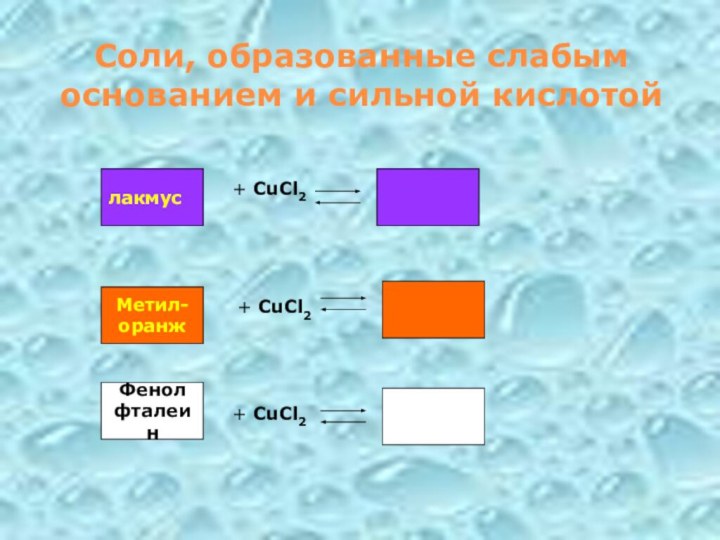
Соли, образованные слабым основанием и сильной кислотой
Фенол
фталеин
+ CuCl2
+
CuCl2
+ CuCl2
лакмус
Метил-
оранж
Слайд 15
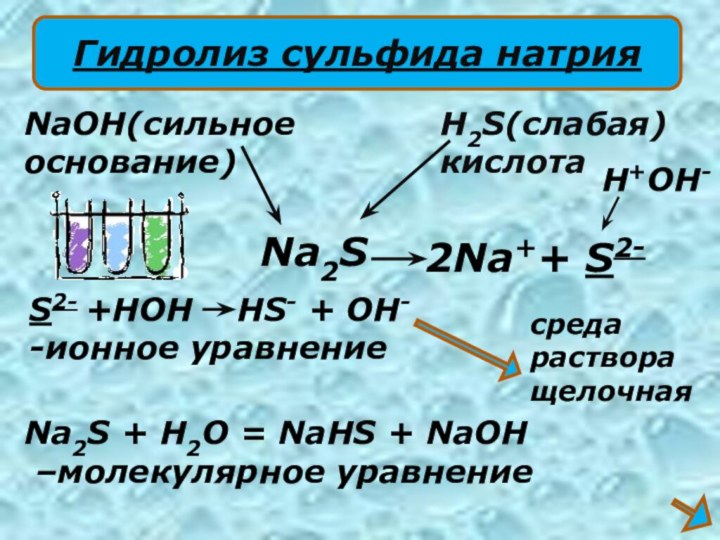
2Na++ S2-
NaOH(сильное
основание)
H2S(слабая)
кислота
S2- +HOH HS-
+ OH-
-ионное уравнение
Na2S + H2O = NaHS +
NaOH–молекулярное уравнение
Na2S
H+OH-
среда
раствора
щелочная
Гидролиз сульфида натрия
Слайд 16
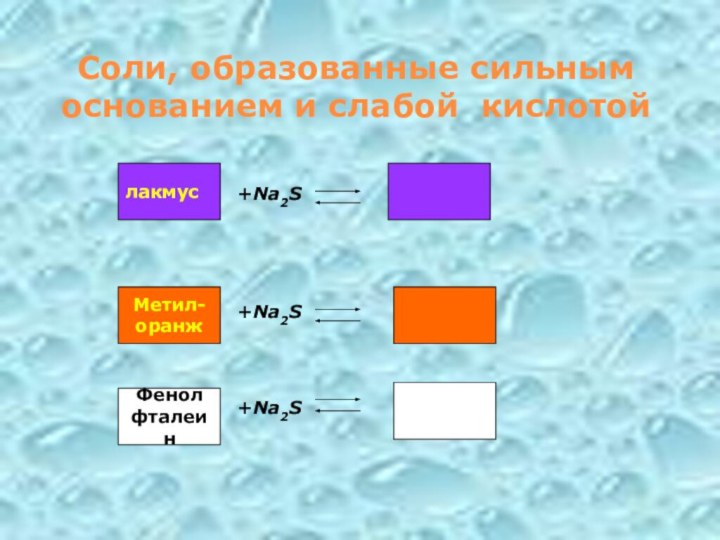
Соли, образованные сильным основанием и слабой кислотой
+Na2S
+Na2S
+Na2S
лакмус
Метил-
оранж
Фенол
фталеин
Слайд 17
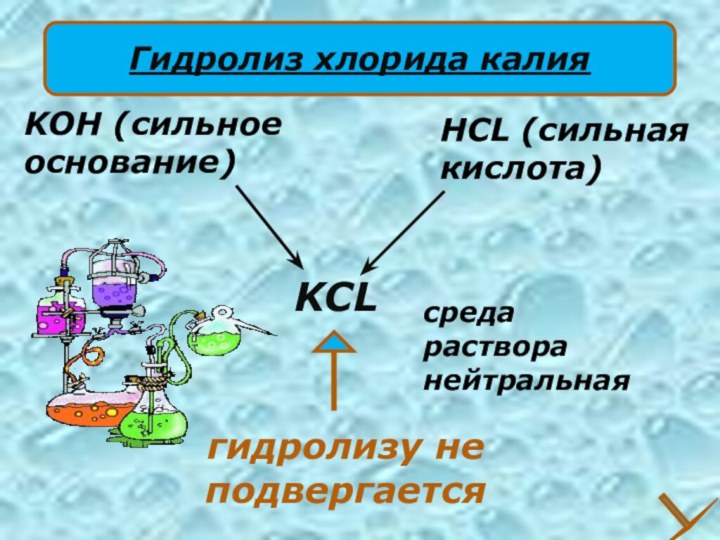
KCL
HCL (сильная
кислота)
KOH (сильное
основание)
гидролизу не подвергается
среда
раствора
нейтральная
Гидролиз
хлорида калия
Слайд 18
Соли, образованные сильным основанием и сильной кислотой
+KCL
+KCL
+KCL
лакмус
Метил-
оранж
Фенол
фталеин
Слайд 19
AL2S3 +6H2O=2AL(OH)3 +3H2S
AL2S3
H2S (слабая
кислота)
AL(OH)3 (слабое
основание)
Гидролиз сульфида алюминия
-
полный необратимый гидролиз
Слайд 20
Соли, образованные слабым основанием и слабой кислотой
+AL2S3
+AL2S3
+AL2S3
лакмус
Метил-
оранж
Фенол
фталеин
Слайд 22 Для умывания, стирки, мытья посуды нужны синтетические моющие
средства, в основе которых содержатся в основном соли сильных
оснований и слабых кислот.При их попадании в воду идет гидролиз с созданием щелочной среды (ОН-), в которой и удаляется грязь.
Загрязнения представляют собой смесь твердых частиц (пыли, сажи, соли, жировых, а также потовых пленок, прилипших к поверхности тканей и других предметов).
Чтобы удалить загрязнения необходимо:
отделить загрязнение от очищаемой поверхности;
перевести грязевые частицы в моющий раствор;
удержать их в моющем растворе и устранить возможность повторного осаждения на очищаемую поверхность.
Слайд 24
Нейтральную среду имеет водный раствор:
1)нитрита натрия
2)силиката калия
3)хлорида железа
(II)
4)нитрата калия
Найди верный ответ
Слайд 25 В водном растворе какой соли фенолфталеин окрашен в
малиновый цвет?
1)CaCl2
2)KNO3
3)FeSO4
4)Na2CO3
Найди верный ответ
Слайд 26 Одинаковую реакцию среды имеют растворы карбоната натрия и
1) нитрата натрия
2) силиката натрия
3) сульфата калия
4) хлорида алюминия
Найди
верный ответ
Слайд 27
ФОРМУЛА
СОЛИ
А) NaNO3
Б) CuF2
В) ALBr3
Г) CH3COONa
1) гидролизуется по
катиону
2) гидролизуется по аниону
3) гидролизуется по катиону
и аниону4) не гидролизуется
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
Установите соответствие между формулой соли и её отношением к гидролизу:
Слайд 29
Гидролиз нитрата алюминия идет по катиону
Гидролиз сульфата бария
идет по аниону
Гидролиз щелочей не возможен
Оксиды подвергаются гидролизу
Хлорид бария
не подвергается гидролизуВ растворе сульфата меди(ll) кислая среда
да
нет
да
нет
да
да
Выберите истинные и ложные утверждения
Слайд 32
В Ы В О Д:
Э Т О
Н У Ж Н О
З Н А
Т Ь И У М Е Т Ь!!!Определение возможности гидролиза соли (по какой составной части)
Определение среды в растворе соли
Определение цвета индикатора в растворе соли
Составление ионных и молекулярных уравнений