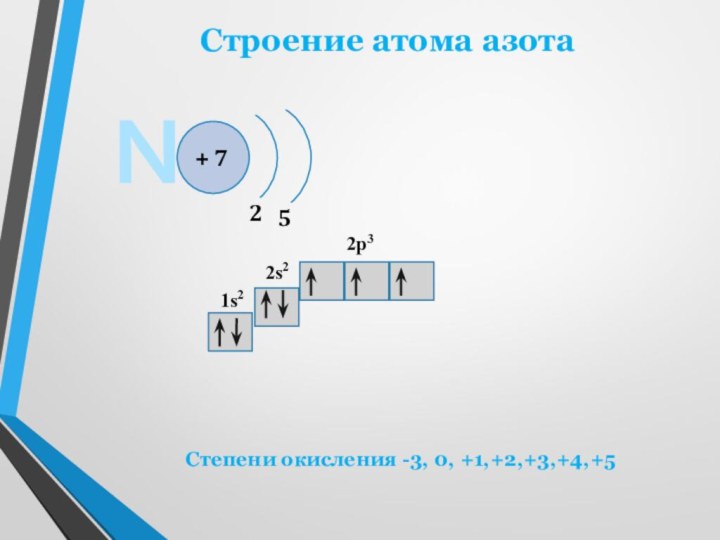
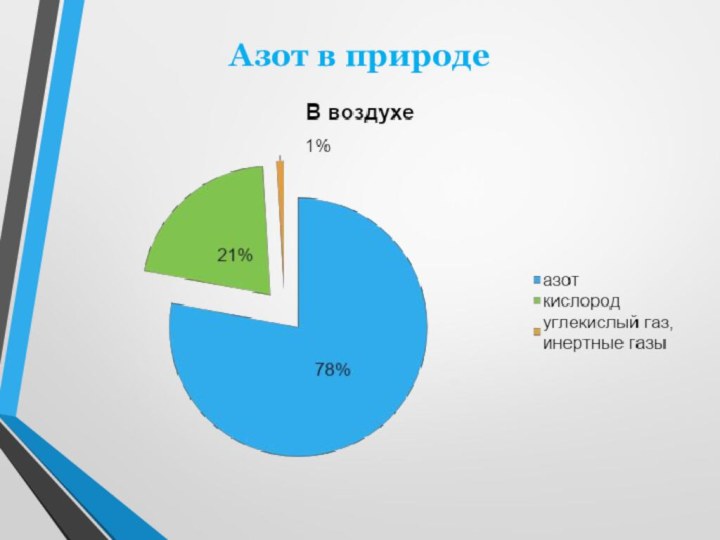
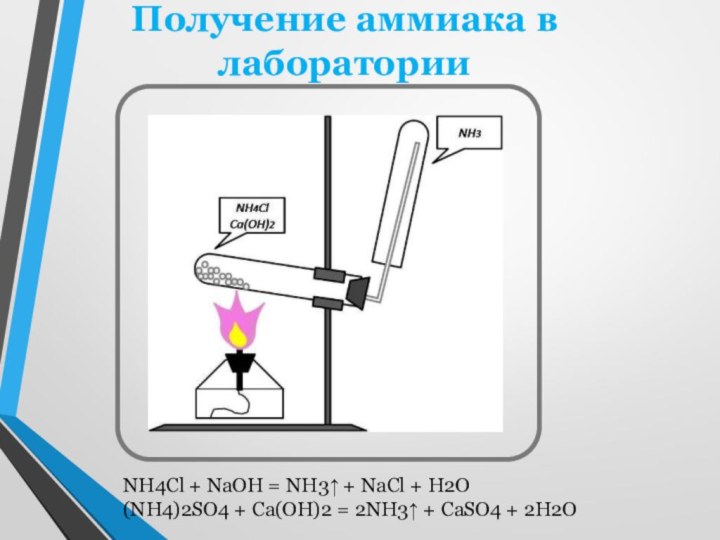
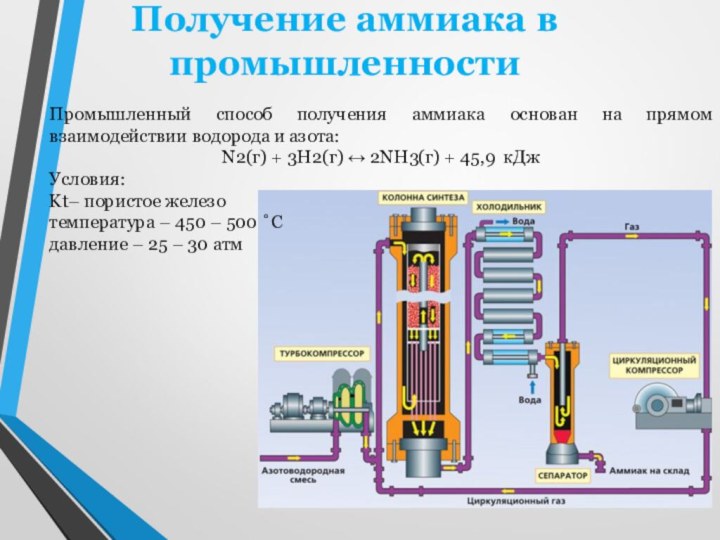
двухатомных молекул N2. В этих молекулах два атома азота
связаны очень прочной тройной ковалентной связью.Азот – бесцветный газ без запаха и вкуса. Плохо растворяется в воде. В жидком состоянии (темп. кипения −195,8 °C) – бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов.