- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Растворы. Классификация дисперсных систем
Содержание
- 2. СодержаниеКлассификация дисперсных системОсновные понятияКонцентрация растворовЭнергетические эффекты при
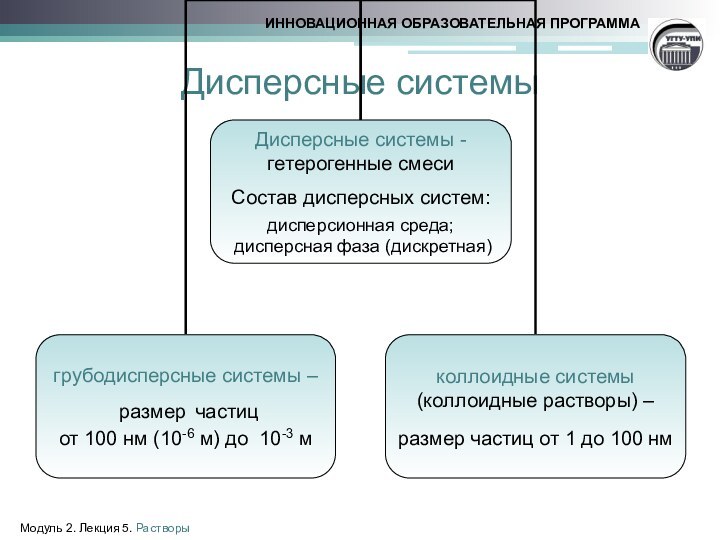
- 3. Дисперсные системыМодуль 2. Лекция 5. Растворы
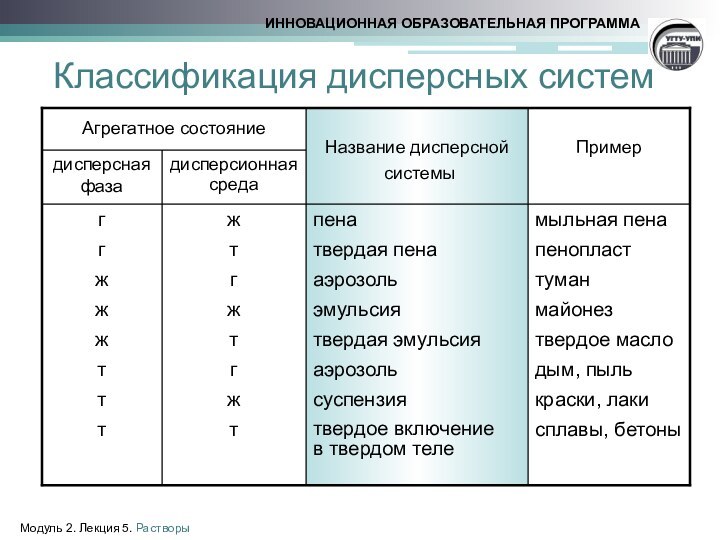
- 4. Классификация дисперсных системМодуль 2. Лекция 5. Растворы
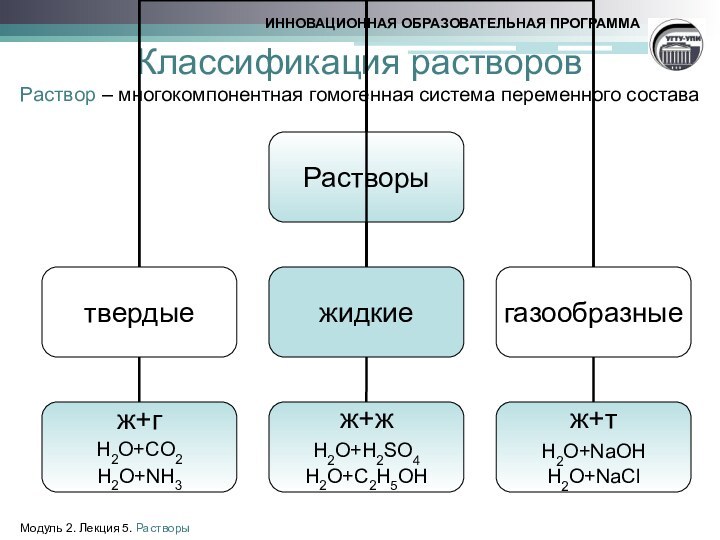
- 5. Классификация растворов Раствор – многокомпонентная гомогенная система переменного состава Модуль 2. Лекция 5. Растворы
- 6. Способы выражения концентрацииМассовая доля вещества – отношение
- 7. Способы выражения концентрацииМолярная доля вещества В –
- 8. Схемы фазового равновесия растворенное вещество
- 9. Насыщенные растворы. РастворимостьНасыщенный раствор – находящийся в
- 10. Физико-химические процессы при растворении Растворение -
- 11. Энергетические эффекты при образовании растворовЗначение энтальпии растворения
- 12. Влияние различных факторов на растворимость газов и
- 13. Растворимость твердых веществ в жидкостях Условное
- 14. Закон распределения Распределение растворяющегося вещества
- 15. Экстракция Метод избирательного извлечения вещества из раствора (или
- 16. ЗаключениеРаствор представляет собой гомогенную систему переменного составаКоличественная
- 17. Скачать презентацию
- 18. Похожие презентации












Слайд 2
Содержание
Классификация дисперсных систем
Основные понятия
Концентрация растворов
Энергетические эффекты при образовании
растворов
Слайд 5
Классификация растворов
Раствор – многокомпонентная гомогенная система переменного состава
Модуль
2. Лекция 5. Растворы
Слайд 6
Способы выражения концентрации
Массовая доля вещества – отношение массы
растворенного вещества (mB) к массе раствора (mp)
Процентная концентрация – отношение массы растворенного вещества (mB) к массе раствора (mp), выраженное в процентах
– плотность раствора, г/мл
Vp – объем раствора, мл
Модуль 2. Лекция 5. Растворы
Слайд 7
Способы выражения концентрации
Молярная доля вещества В – отношение
количества вещества В
к общему количеству веществ,
образующих раствор i – число веществ в растворе
Молярная концентрация (молярность) – отношение количества растворенного вещества к объему раствора (Vp), выраженному
в литрах. Размерность молярной концентрации – моль/л
mB – масса растворенного вещества В, г
МB – молярная масса растворенного вещества В, г/моль
Модуль 2. Лекция 5. Растворы
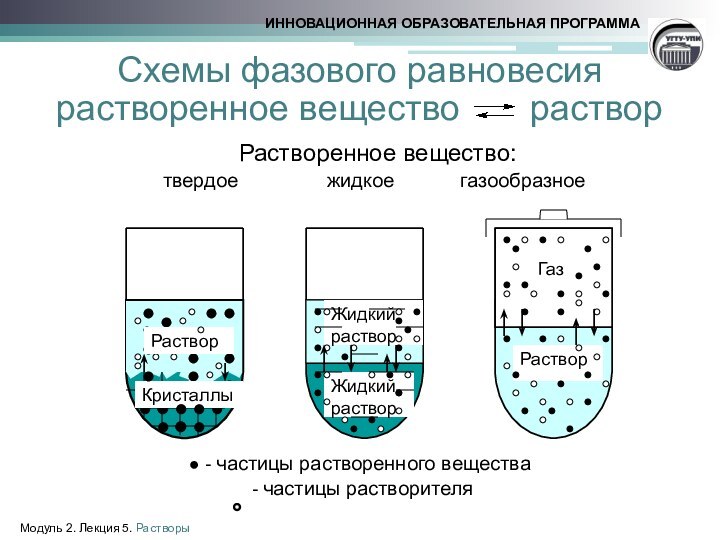
Слайд 8 Схемы фазового равновесия растворенное вещество раствор
Растворенное вещество:
твердое жидкое газообразное● - частицы растворенного вещества
- частицы растворителя
Модуль 2. Лекция 5. Растворы
Кристаллы
Раствор
Жидкий
раствор
Жидкий
раствор
Газ
Раствор
Слайд 9
Насыщенные растворы. Растворимость
Насыщенный раствор – находящийся в фазовом
равновесии с растворяемым веществом
Растворимость вещества (моль/л) при данных
температуре и давлении определяется концентрацией насыщенного раствораНенасыщенные растворы – в которых содержание растворенного вещества меньше, чем в насыщенном растворе этого же вещества при данных температуре и давлении
Пересыщенные растворы – в которых содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества при данных температуре и давлении. Пересыщенные растворы неустойчивы
Модуль 2. Лекция 5. Растворы
Слайд 10
Физико-химические процессы
при растворении
Растворение - совокупность физико-химических
процессов, среди которых выделяют три основных, протекающих одновременно:
разрыв внутри-
и межмолекулярных связей в растворяющемся веществе(в том числе, разрушение кристаллической решетки в твердых веществах) частичный или полный разрыв связей между молекулами растворителя
образование связей между частицами растворенного вещества и молекулами растворителя - сольватация (или гидратация)
Модуль 2. Лекция 5. Растворы
Слайд 11
Энергетические эффекты при образовании растворов
Значение энтальпии растворения (уравнение
Фаянса):
где ΔНK – энтальпия разрушения кристаллической решетки
растворяемого вещества (ΔНK>0)ΔHP – энтальпия разрыва межмолекулярных связей
растворителя (ΔНP>0)
ΔНС – энтальпия сольватации (ΔНС<0).
При растворении газов или жидкостей
как правило, ΔH<0
Для большинства твердых веществ
ΔH>0
Пример: NH4NO3(к) = NH4NO3(раствор) , ΔH0 = 25,8 кДж
Модуль 2. Лекция 5. Растворы
Слайд 12 Влияние различных факторов на растворимость газов и жидкостей
Растворимость газов в жидкостях
С повышением температуры растворимость, как правило,
понижаетсяЗакон Генри: растворимость газа в жидкости при постоянной температуре пропорциональна его давлению в газовой фазе
Взаимная растворимость жидкостей
В зависимости от природы веществ возможны три варианта растворимости: неограниченная (H2O - C2H5OH), ограниченная (H2O - анилин), практически полная нерастворимость (H2O - ртуть)
С повышением температуры растворимость в большинстве случаев увеличивается
Модуль 2. Лекция 5. Растворы
Слайд 13
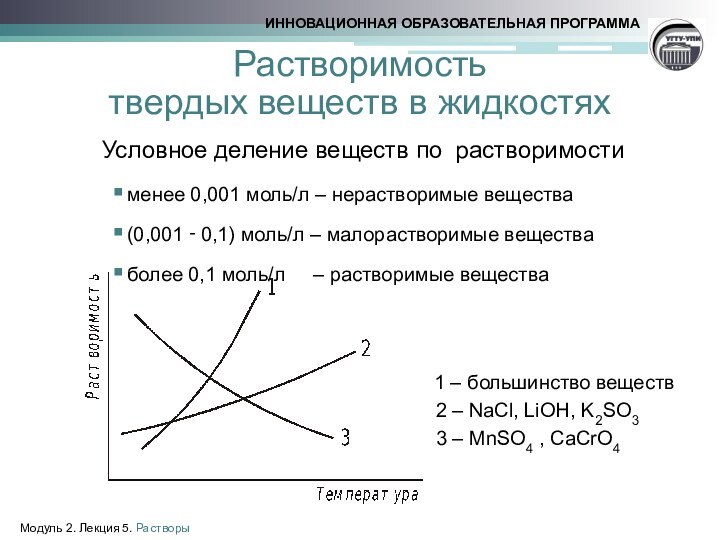
Растворимость
твердых веществ в жидкостях
Условное деление веществ
по растворимости
менее 0,001 моль/л – нерастворимые вещества
(0,001 ‑ 0,1) моль/л – малорастворимые
веществаболее 0,1 моль/л – растворимые вещества
1 – большинство веществ
2 – NaCl, LiOH, K2SO3
3 – MnSO4 , CaCrO4
Модуль 2. Лекция 5. Растворы
Слайд 14
Закон распределения
Распределение растворяющегося вещества между
двумя несмешивающимися жидкостями происходит так, что отношение его равновесных
концентраций в этих фазах есть величина постояннаягде С1 и С2 – молярные концентрации растворенного
вещества в фазах 1 и 2 соответственно
К – коэффициент распределения
Величина К определяется природой растворенного вещества и несмешивающихся фаз, температурой, не зависит от общего количества растворенного вещества
Модуль 2. Лекция 5. Растворы
Слайд 15
Экстракция
Метод избирательного извлечения вещества из раствора (или твердой
смеси) с помощью подходящего растворителя – экстрагента
Схема делительной воронки и последовательность действий:Модуль 2. Лекция 5. Растворы
наливают экстрагент и исходный раствор, содержащий извлекаемый компонент
перемешивают жидкости
происходит расслоение, извлекаемый компонент в основном переходит в экстрагент, образуется экстракт
нижний слой жидкости сливают
Слайд 16
Заключение
Раствор представляет собой гомогенную систему переменного состава
Количественная характеристика
состава раствора - концентрация растворенного вещества: массовая доля, процентная,
молярная концентрация и др.Раствор, находящийся в фазовом равновесии с растворяемым веществом, называют насыщенным. Концентрация насыщенного раствора – мера растворимости вещества
Растворение может быть эндотермическим и экзотермическим процессом:
растворимость газов в жидкостях , как правило, уменьшается при нагревании, растворимость жидкостей – увеличивается;
растворение большинства твердых веществ в жидкостях процесс эндотермический – при нагревании растворимость увеличивается; если растворение процесс экзотермический ‑ растворимость уменьшается
Для любого растворенного вещества, распределяющегося между несмешивающимися жидкостями, справедлив закон распределения, на действии которого основаны методы экстракции ‑ избирательного извлечения веществ из смесей
Модуль 2. Лекция 5. Растворы