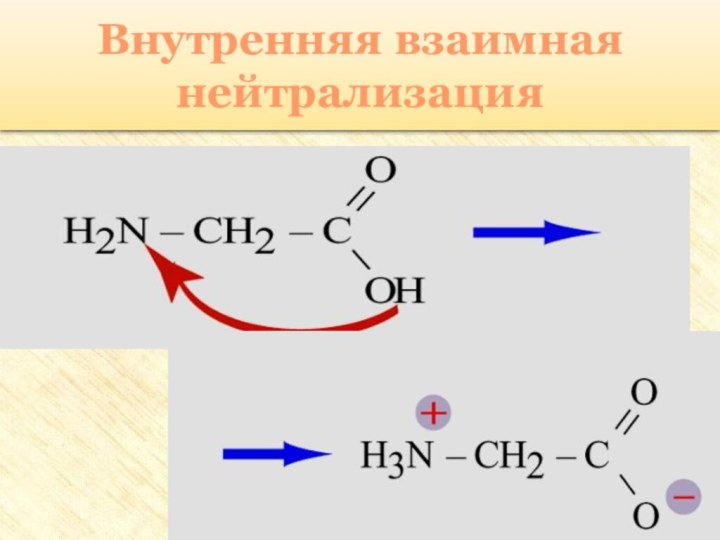
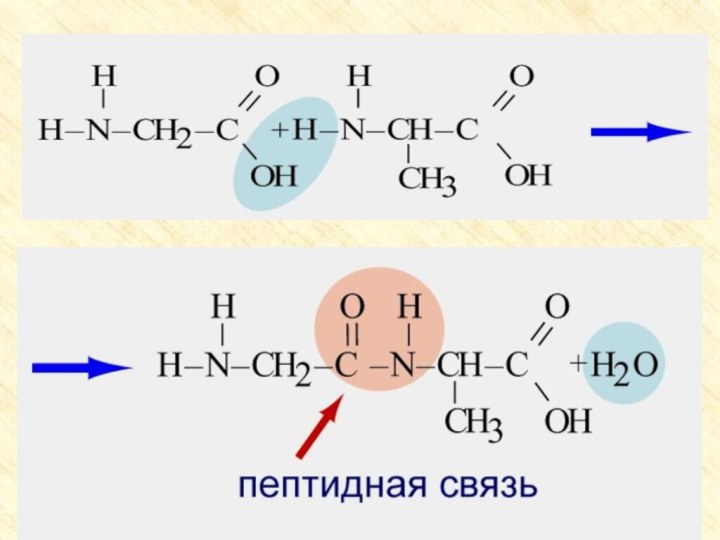
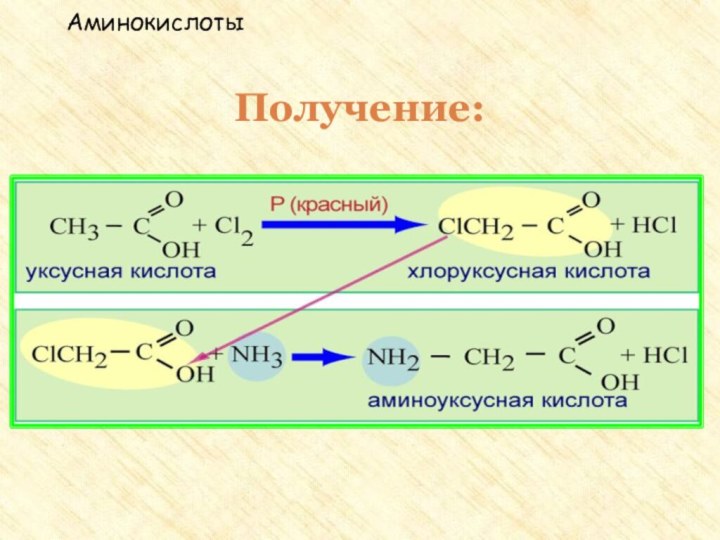
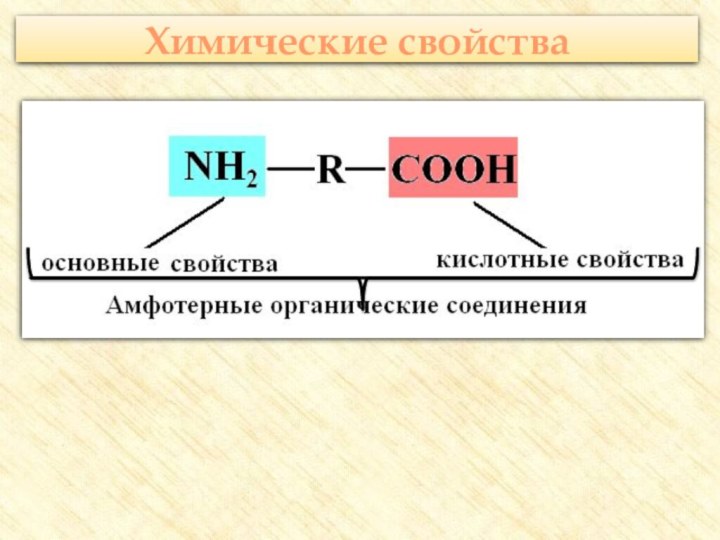
две функциональные группы: аминогруппу – NH2 и карбоксильную группу
– COOH, связанные с углеводородным радикаломАминокислоты – производные кислот, которые можно рассматривать как продукты замещения одного или более атомов водорода в их радикалах на одну или более аминогрупп





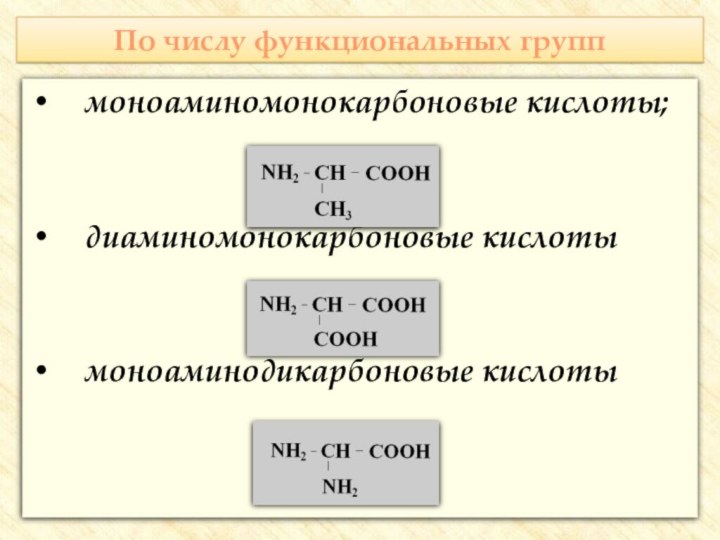









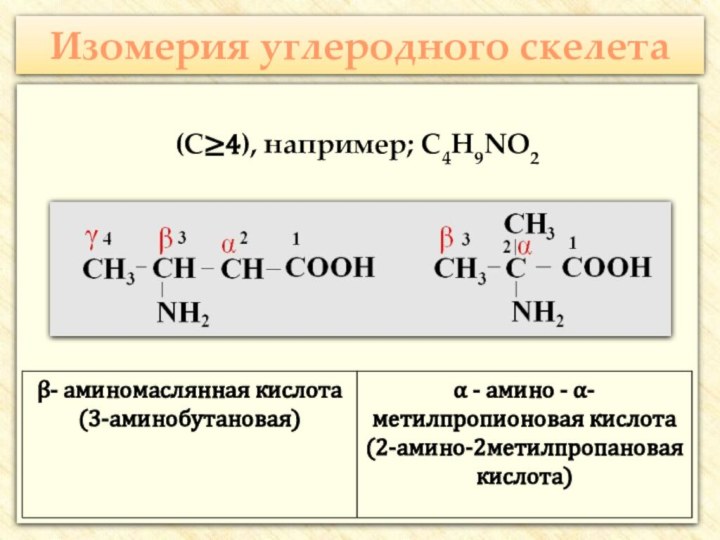

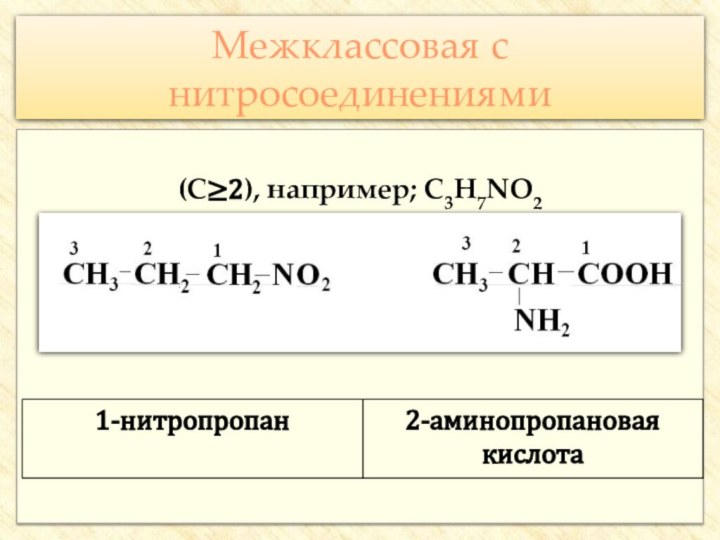
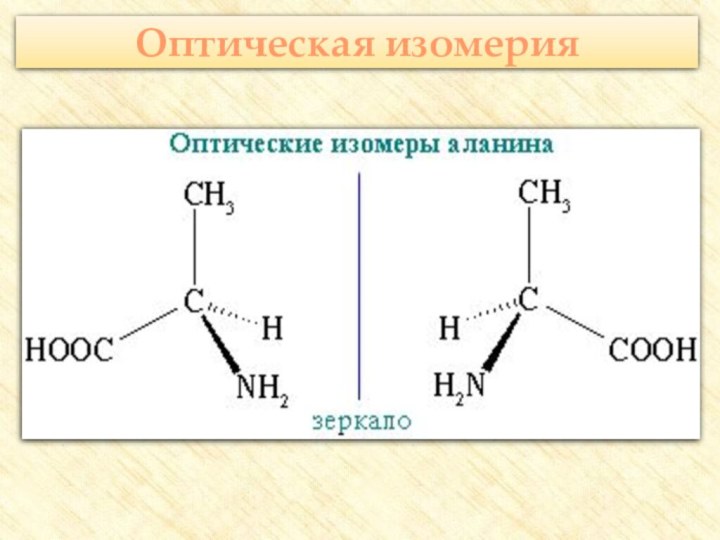


![Презентация к уроку по теме: Аминокислоты Реакции с участием аминогруппыВзаимодействуют с кислотами:H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-](/img/tmb/7/647818/08b0f1bc7f4cfd8af2f2c0366d1f651e-720x.jpg)