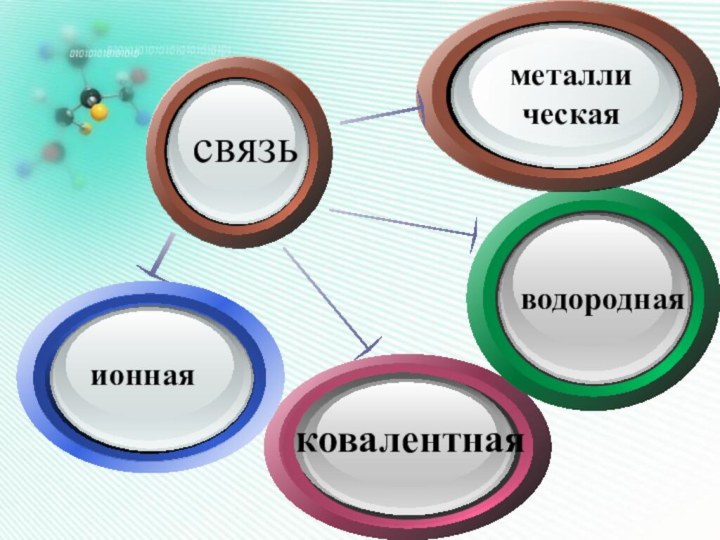
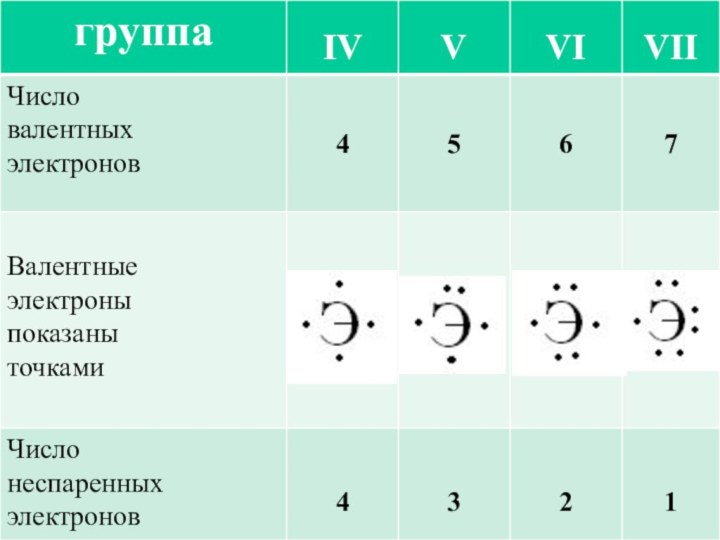
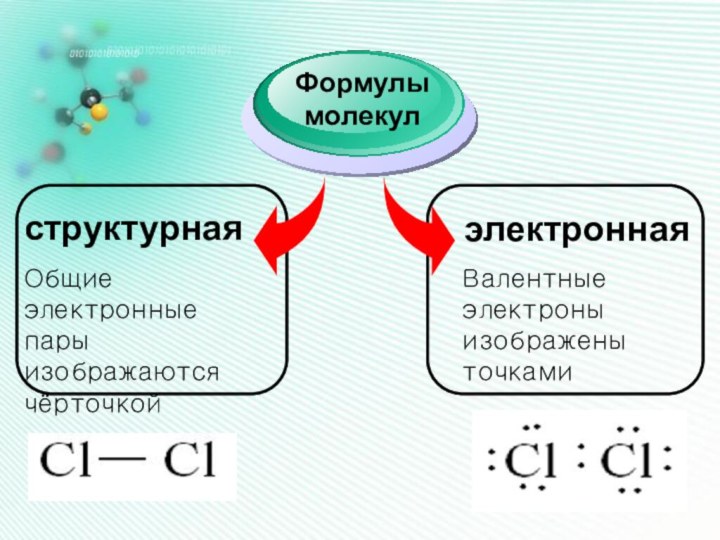
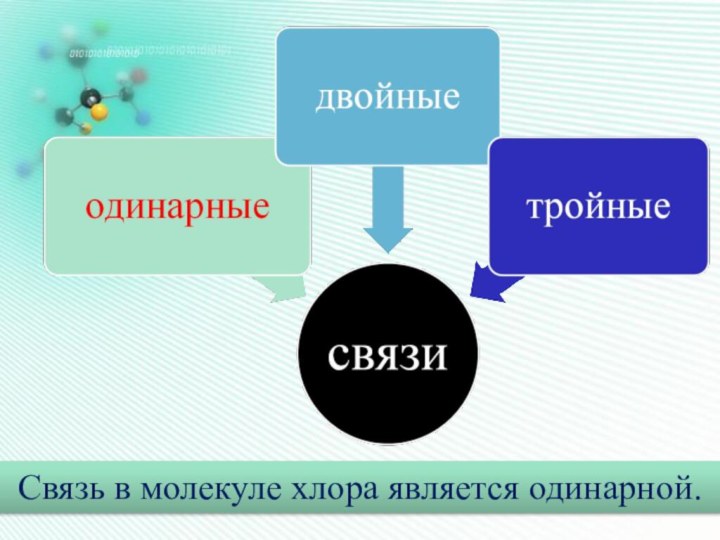
Он наиболее устойчив и
стабилен, что является причиной
инертности
атомов благородных газов. Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа и перейти в наиболее
устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.