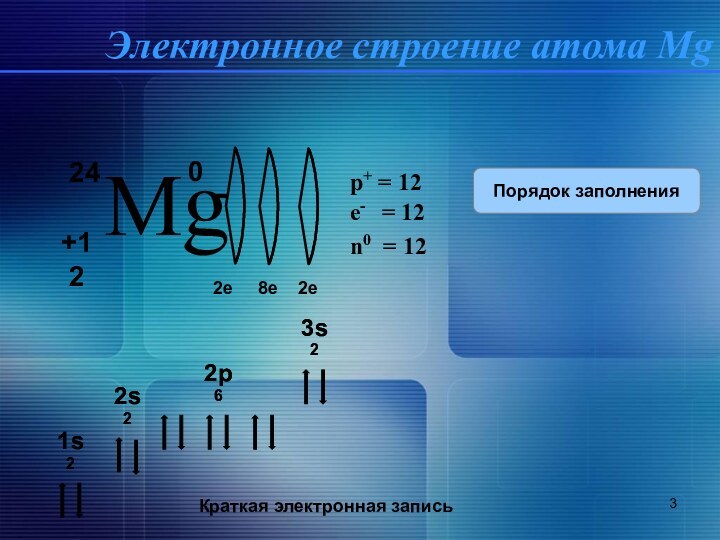
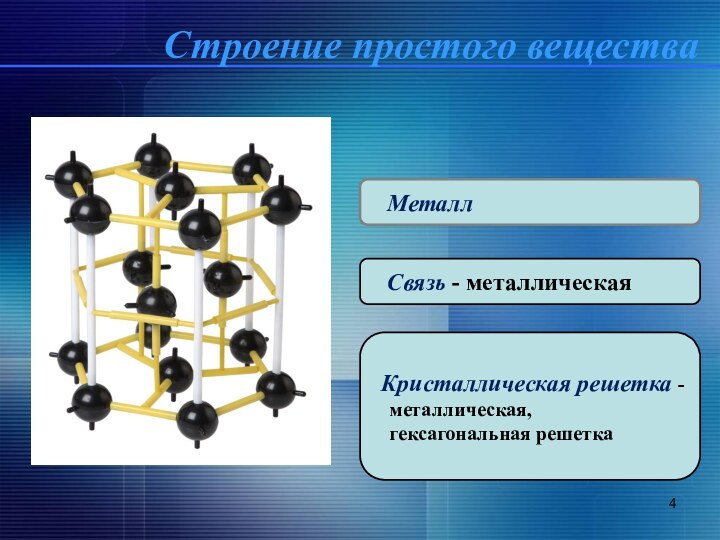
свойства Mg
Горение Mg в кислороде
Горение Mg в воде
Горение Mg
в хлореВспышка смеси Mg + AgNO3 от капли воды
Лабораторная работа: «Горение магния на воздухе»
Магнийтермия
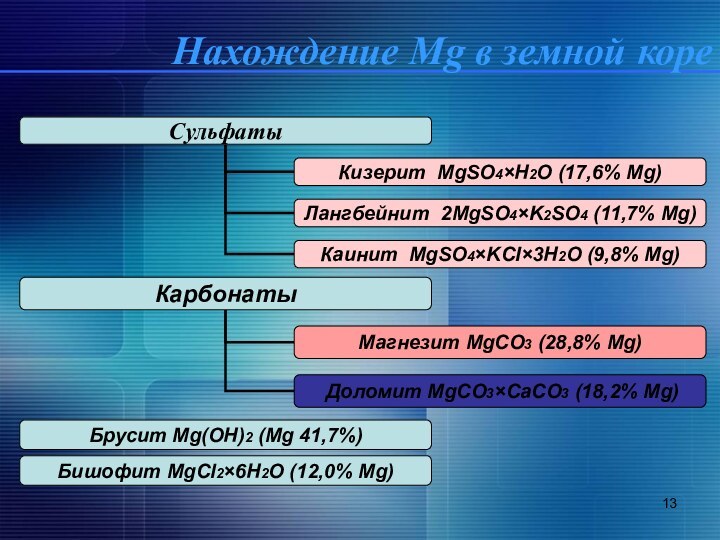
Нахождение Mg в земной коре
Получение Mg
Применение Mg и его сплавов
Отзыв
Интернет-ресурсы