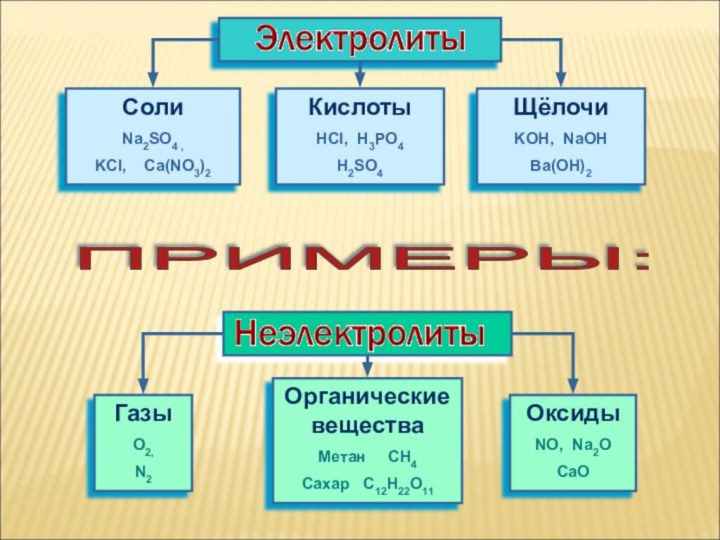
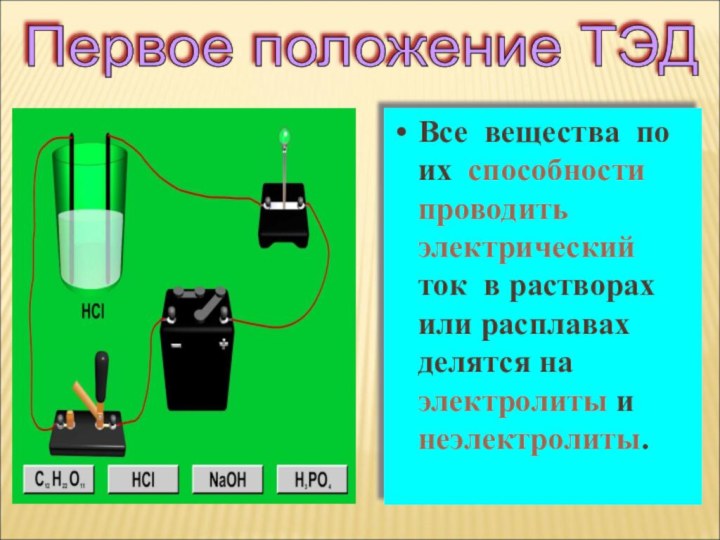
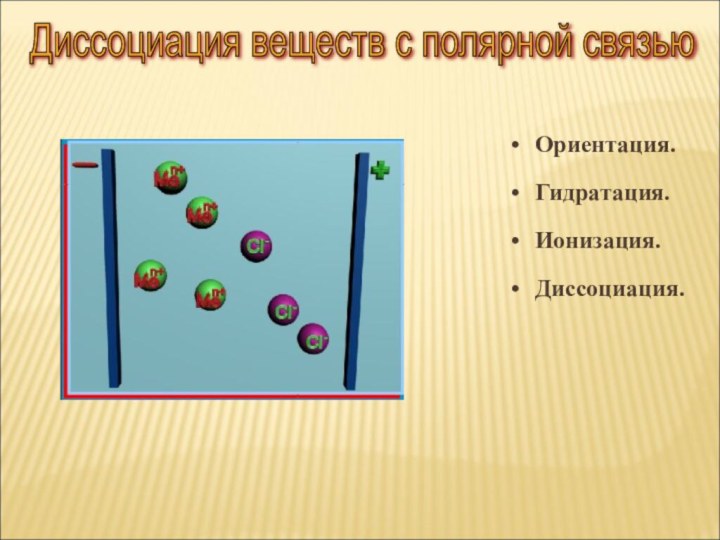
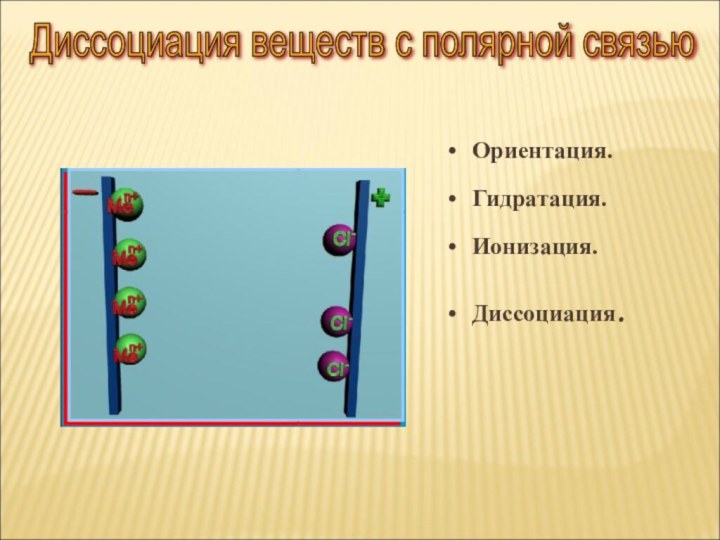
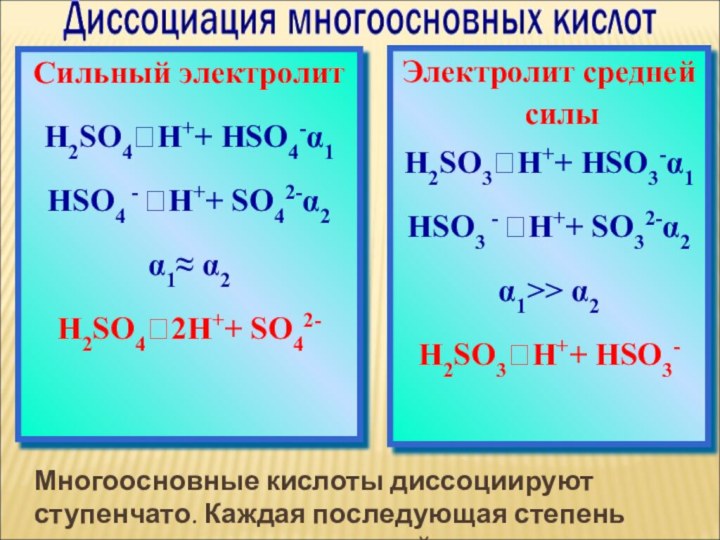
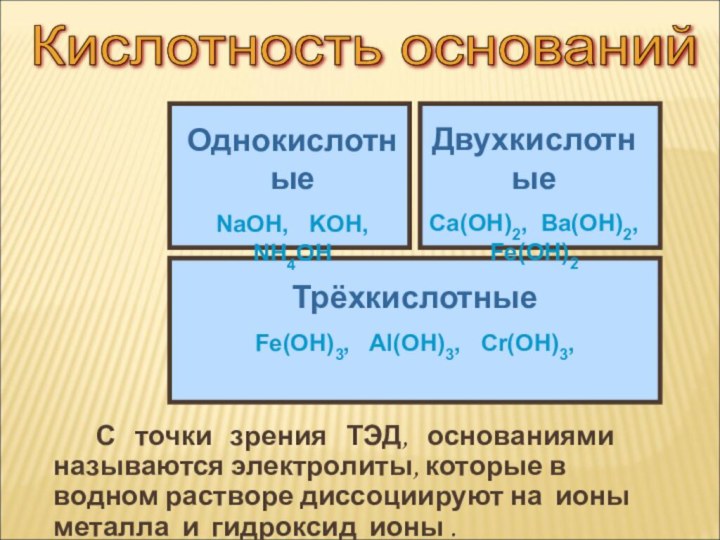
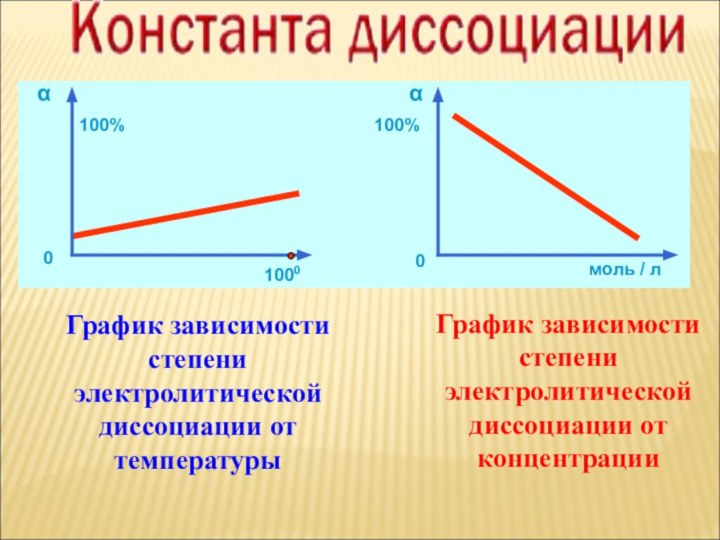
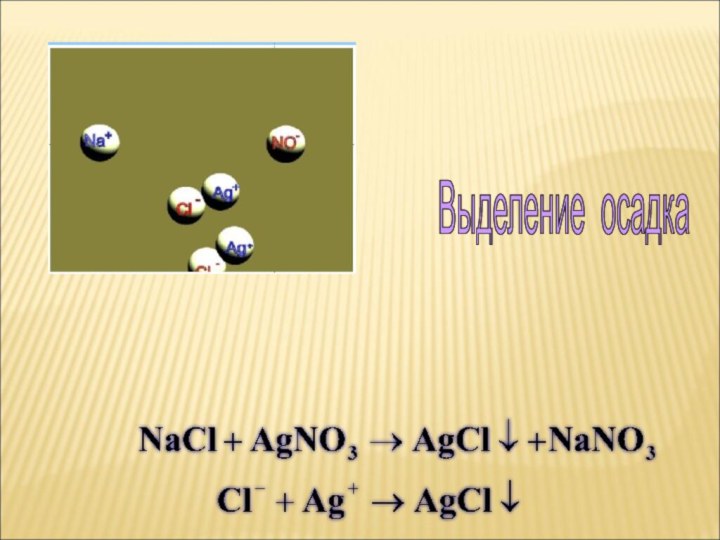
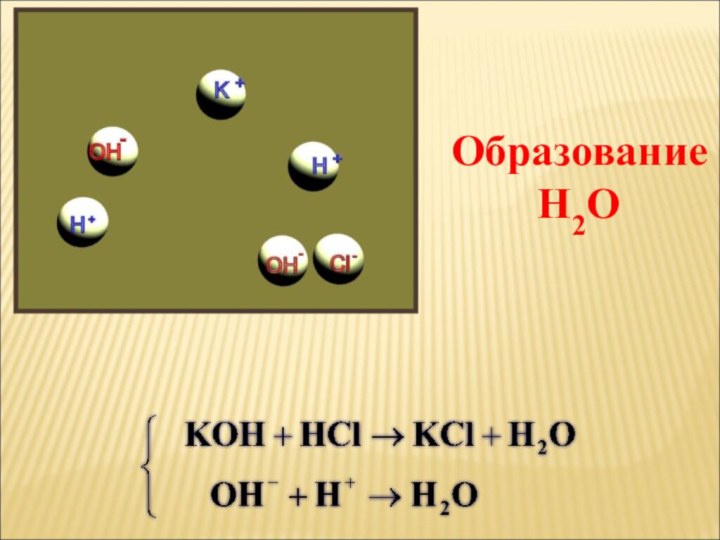
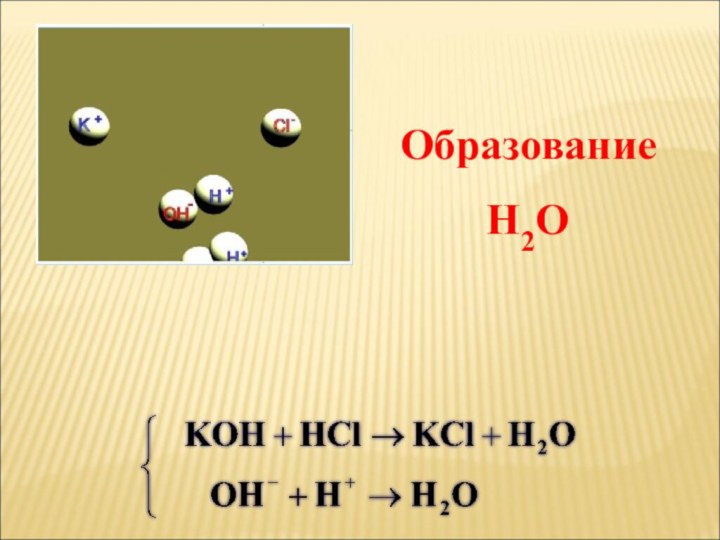
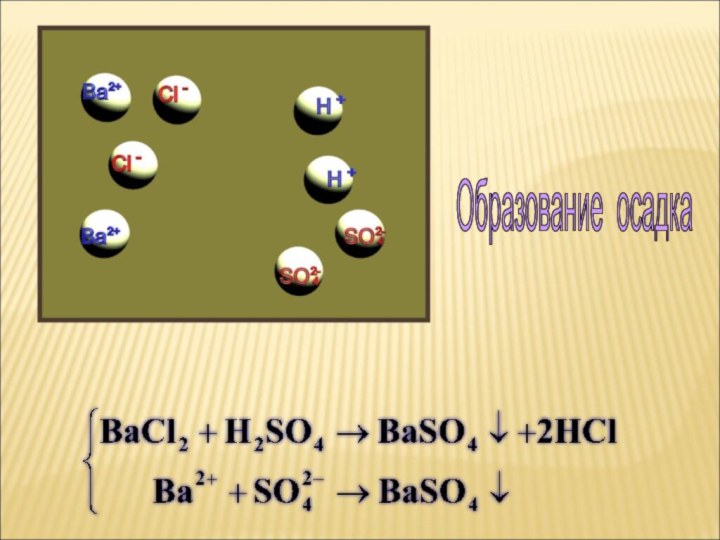
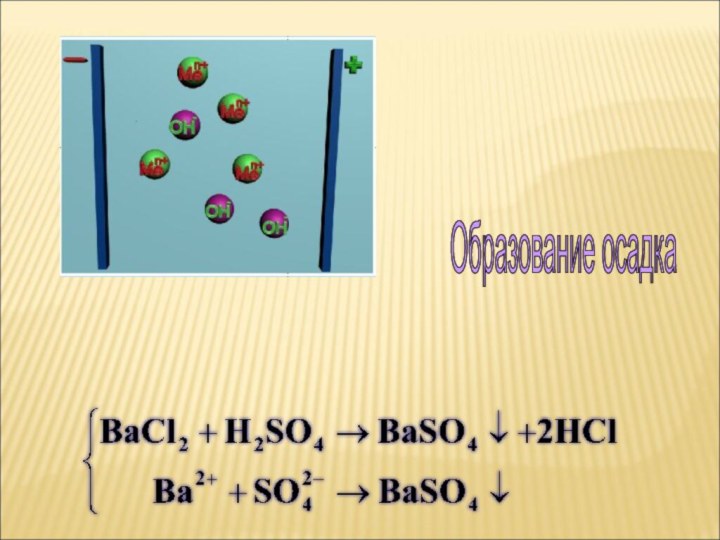
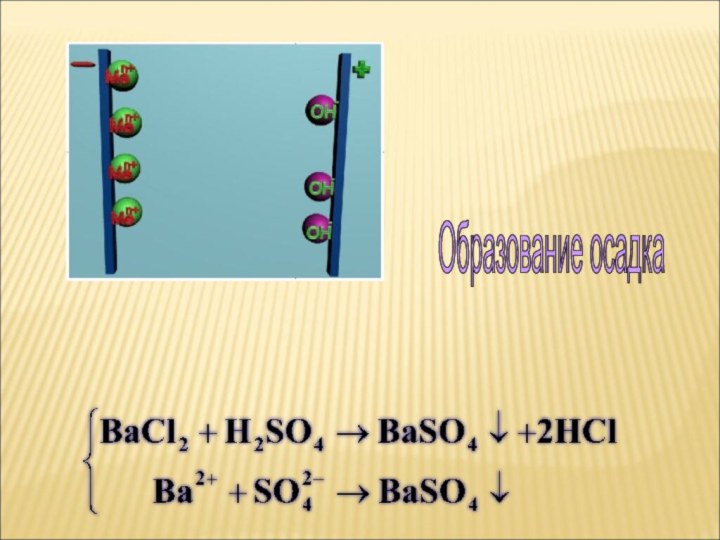
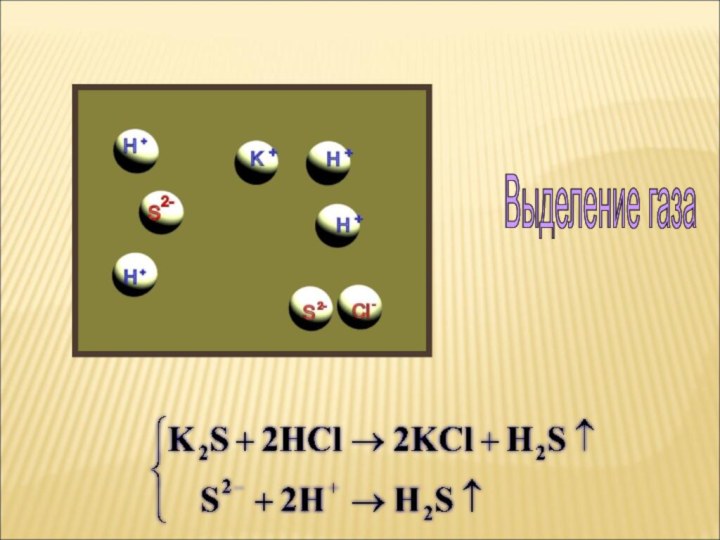
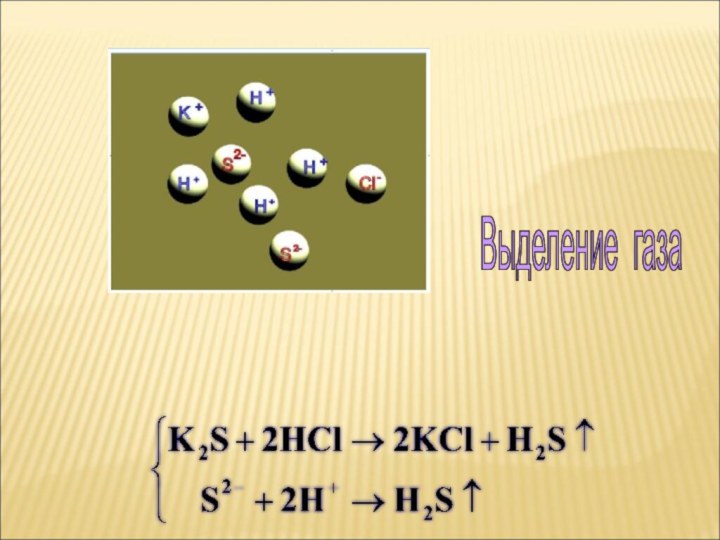
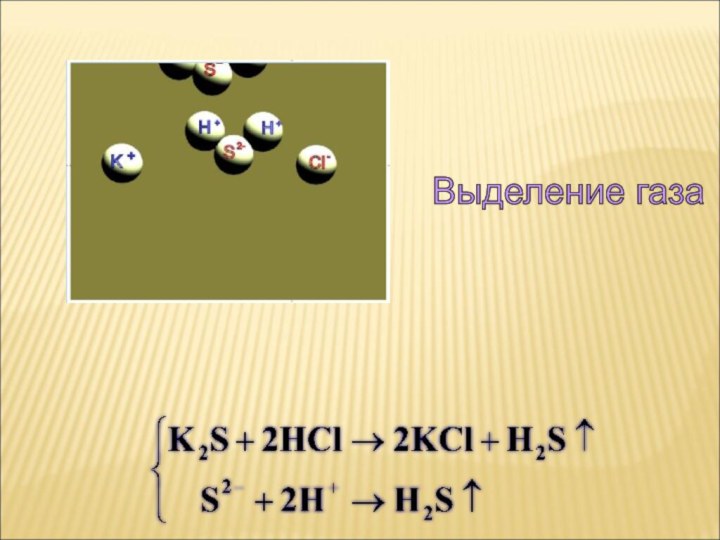
ток
их растворы
или расплавы
НЕ ПРОВОДЯТ электрический
токВид химической связи
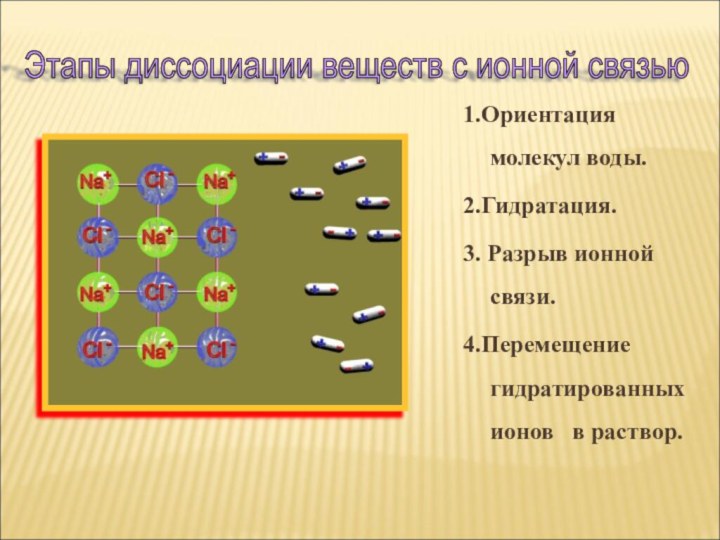
Ионная или ковалентная
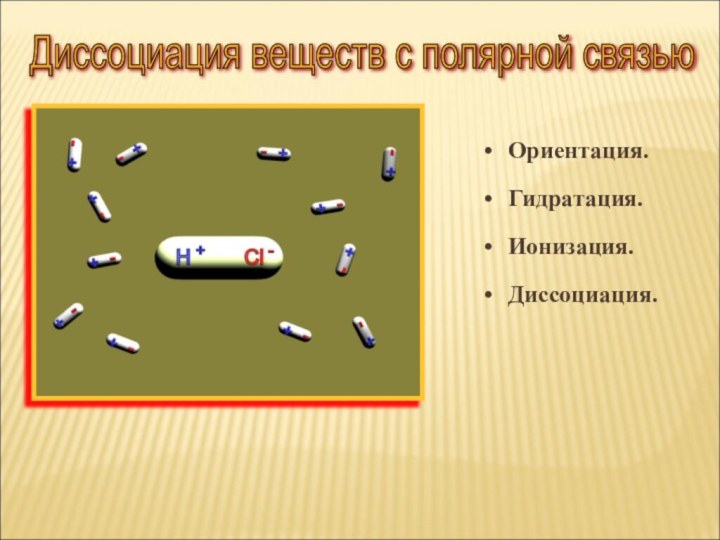
сильно полярная
Ковалентная неполярная
или мало полярная
Все вещества по отношению к электрическому току можно разделить на