- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Тотықтырғыш және тотықсыздандырғыш туралы түсінік. Тотығу- тотықсыздану реакциялары.
Содержание
- 2. Сабақтың мақсатыОқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция жайындағы білімдерін жүйелеу және қорытындылау..
- 3. Тотығу – тотықсыздану реакцияларыТотығу - тотықсыздану процесі
- 4. Тотығу – тотықсыздану реакциялары
- 5. Тотығу – тотықсыздану реакциялары 20-
- 6. Тотығу - тотықсыздану реакциялары (ТТР)- – Химиялық реакцияларда әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежесінің өзгеруі.
- 7. Тотығу дәрежесіЖай заттардың құрамына кіретін элемент атомының
- 8. Тотығу – тотықсыздану реакциясын танып білуРеакция теңдеуіндегі
- 9. Тотықтырғыш пен тотықсыздандырғышты танып білу
- 10. Электронды баланс әдісі
- 11. Реакцияның жүруіне ортаның әсері +7Mn
- 12. Реакцияның жүруіне ортаның әсері
- 13. Реакцияның жүруіне ортаның әсері
- 14. Реакцияның жүруіне ортаның әсері
- 15. Электронды баланс әдісі арқылы реакция теңдеуін
- 16. Электронды баланс әдісі арқылы реакция теңдеуін
- 17. Электронды баланс әдісі арқылы реакция теңдеуін
- 18. Электронды баланс әдісі арқылы реакция теңдеуін
- 19. Тотығу - тотықсыздану реакцияларының маңызы
- 20. Аккумуляторлар Zn +H2SO4 → ZnSO4 + H2↑
- 21. Глюкозаның ашуыАшу цехыC6H12O6 → 2C2H5OH + 2CO2
- 22. Скачать презентацию
- 23. Похожие презентации
Сабақтың мақсатыОқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция жайындағы білімдерін жүйелеу және қорытындылау..



















Слайд 2
Сабақтың мақсаты
Оқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция жайындағы
білімдерін жүйелеу және қорытындылау..
Слайд 3
Тотығу – тотықсыздану реакциялары
Тотығу - тотықсыздану процесі ең
кеңінен тараған және теориямен практикада маңызды роль атқаратын реакция
болып табылады. Тірі ағзаларда жүретін зат алмасу, шіру, ашу, фотосинтез процестері тығыз байланысты. Тотығу - тотықсыздану процесі табиғаттағы заттар айналымын жүзеге асырады. Отынның жануы, металдар коррозиясы, металдар құймаларын дайындау және электролиз процестерінде жүзеге асырады.
Слайд 4
Тотығу – тотықсыздану реакциялары
Олардың көмегімен
сілті, қышқыл және бағалы өнімдер алынады. Тотығу - тотықсыздану
реакциялары әрекеттесуші химиялық заттарда гальвани және отын элементтерінде пайда болатын электр энергиясын тудырады. Адамзат баласы тотығу – тотықсыздану реакциясының мәнін толық түсіне алмаса да, оны кеңінен пайдаланды.
Слайд 5
Тотығу – тотықсыздану реакциялары
20- шы ғасырдың
басында ғана тотығу - тотықсыздану процесінің электрондық
теориясы ашылды. Енді осы ерітінділерде жүретін теория тұрғысынан химиялық реакциялар теңдеулерін құрып, осы реакциялардың жүру механизмін қарастырамыз.
Слайд 6
Тотығу - тотықсыздану реакциялары (ТТР)-
– Химиялық реакцияларда
әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежесінің өзгеруі.
Слайд 7
Тотығу дәрежесі
Жай заттардың құрамына кіретін элемент атомының тотығу
дәрежесі нөльге тең.
Сутектің тотығу дәрежесі гидридтерден басқа қосылыстарды
+1 тең.Оттектің тотығу дәрежесі пероксидтер мен фтор қосылыстарынан басқа қосылыстарында -2 тең.
Қосылыстың құрамындағы барлық атомдардың тотығу дәрежесінің қосындысының жиынтығы нөльге тең.
Иондағы атомдардың тотығу дәрежесінің жиынтық қосындысы ион зарядына тең болады.
Mgº, Cl2º, O2º
+1 +1 -1
HCl, H2O, NaH
-2 -1 +2
H2O, Н2О2, OF2
+1 +6 -2
H2SO4
2(+1)+6+4(-2)=0
+6 -2
SO4
6+4(-2)=-2
Слайд 8
Тотығу – тотықсыздану реакциясын танып білу
Реакция теңдеуіндегі барлық
элементтердің тотығу дәрежесінің мәнін жазу
Элемент атомының тотығу
дәрежесі өзгеріске ұшырауын анықтаймыз.+2 -2 +1 -1 +2 -1 +1 -2
PbO + 2HCl → PbCl2 + H2O
Тотығу дәрежесі өзгерімесе => реакция тотығу - тотықсыздану реакциясы болмайды
һ4 -2 +1 -1 +2 -1 0 +1 -2
PbO2 + 2HCl → PbCl2 + Cl2 + 2H2O
Тотығу дәрежесі өзгеретін болса > реакция тотығу - тотықсыздану реакциясы болып табылады
Слайд 9
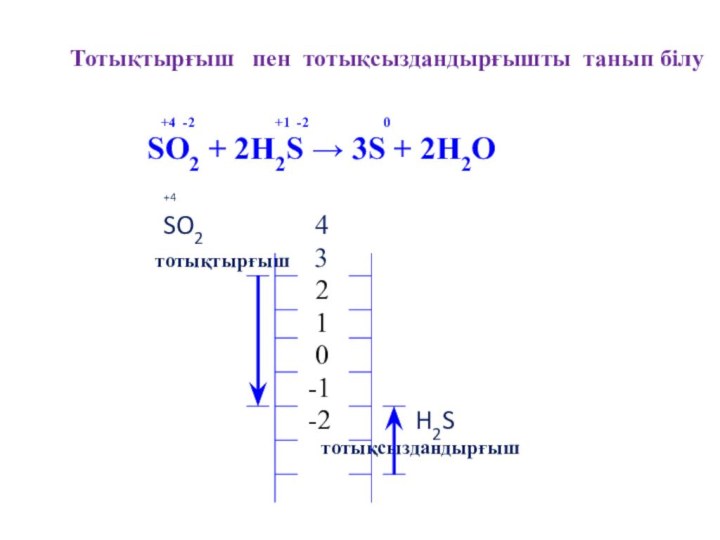
Тотықтырғыш пен тотықсыздандырғышты танып білу
+4 -2 +1 -2 0
SO2 + 2H2S → 3S + 2H2O
+4
SO2 4
тотықтырғыш 3
2
1
0
-1
-2 H2S
тотықсыздандырғыш
Слайд 10
Электронды баланс әдісі
+4 -2
+1 -2 0SO2 + 2H2S → 3S + 2H2O
+4 0 +4 _ 0
S → S S +4 e → S 1
_
+4 → 0 e қосып алу – тотықсыздану
+4 +(-4)=0
-2 0 -2 _ 0
S → S S – 2 e → S 2
_
-2 → 0 e беру – тотығу
-2 - (-2)=0
Слайд 12
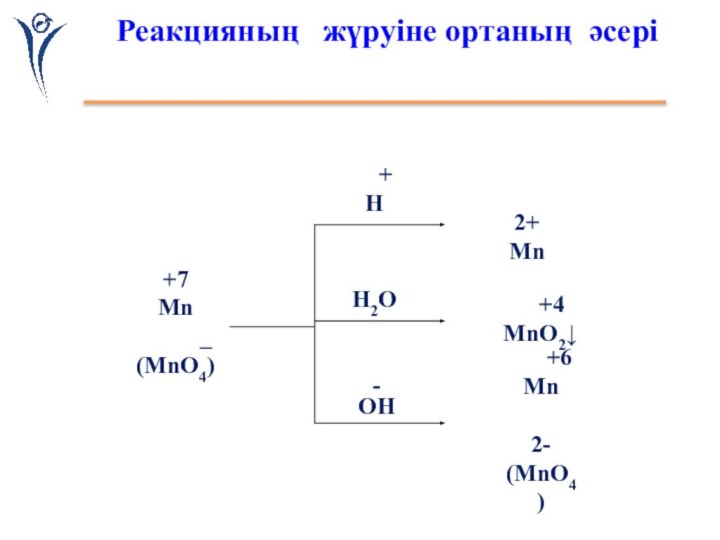
Реакцияның жүруіне ортаның әсері
Қышқылды
ортада:
2KMnO4 + 5Na2SO3+3H2SO4= 2MnSO4 +
+ 5 Na2SO4 + 3H2O
+ K2SO42 Mn+7 + 5e- = Mn+2
5 S+4 -2e- = S+6
Слайд 13
Реакцияның жүруіне ортаның әсері
Бейтарап
ортада:
2KMnO4 + 3Na2SO3+H2O= 2MnO2 + 3Na2SO4 + 2KOH
2
Mn+7 +3e- =Mn+43 S+4 -2e- = S+6
Слайд 14
Реакцияның жүруіне ортаның әсері
Сілтілік
ортада:
2KMnO4 + Na2SO3+2KOH= K 2MnO4 + Na2SO4 +
+
H2O2 Mn+7 + e- =Mn+6
3 S+4 -2e- = S+6
Слайд 15
Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу
дәрежесі сілтілік ортада
+7 ден +6 дейін өзгереді
FeSO4 сілтілік
ортада Fe(OH)3 өзгереді FeSO4+KMnO4+3KOH→ Fe(OH)3 +K2SO4+K2MnO4
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 16
Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу
дәрежесі қышқылдық ортада
+7 ден + 2 дейін өзгереді
FeSO4
қышқылдық ортада Fe2 (SO4)3 өзгереді 10FeSO4+2KMnO4+ 8H2SO4→ 5Fe2 (SO4)3 +K2SO4+ 2MnSO4 + 8H2O
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 17
Электронды баланс әдісі арқылы реакция
теңдеуін құрыңыз:
FeSO4+KMnO4+…→…+K2SO4+K2MnO4
Mn тотығу
дәрежесі қышқылдық ортада
+7 ден + 2 дейін өзгереді
FeSO4
қышқылдық ортада Fe2 (SO4)3 өзгереді 10FeSO4+2KMnO4+ 8H2SO4→ 5Fe2 (SO4)3 +K2SO4+ 2MnSO4 + 8H2O
FeSO4 – тотықсыздандырғыш, KMnO4 – тотықтырғыш
Слайд 18 Электронды баланс әдісі арқылы реакция теңдеуін құрыңыз: Fe(OH)2+KMnO4+ H2O…→…+KOH
+ MnO2
Mn тотығу дәрежесі бейтарап ортада
+7 ден +
4 дейін өзгередіFe(OH)2 бейтарап ортада Fe (OН)3 өзгереді
6Fe(OH)2+2 KMnO4+ 4 H2O → 6Fe (OH)3 + 2KOH + 2MnO2
Fe(OH)2 – тотықсыздандырғыш, KMnO4 – тотықтырғыш