- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алкадиены
Содержание
- 2. Цель урока:опираясь на имеющиеся знания по углеводородам, изучить класс алкадиеныФорма организации познавательной деятельности: самостоятельная работа обучающихся
- 3. Основные теоретические сведенияНазвание класса:Классификация:Характеристические признаки:Общая формула:
- 4. Основные теоретические сведенияНазвание класса: алкадиены, диеновые углеводородыКлассификация:
- 5. Алкадиены с кумулированными двойными связямиПример:Другие названия:Особый характеристический признак:Тип гибридизации атома углерода:Геометрия молекул:
- 6. Алкадиены с кумулированными двойными связямиПример: СН2 =
- 7. Алкадиены с сопряжёнными двойными связямиПример:Другие названия:Особый характеристический признак:Тип гибридизации атома углерода:Геометрия молекул:
- 8. Алкадиены с сопряжёнными двойными связямиПример: СН3 –
- 10. Алкадиены с изолированными двойными связямиПример:Другие названия:Особый характеристический признак:Тип гибридизации атома углерода:Геометрия молекул:
- 11. Алкадиены с изолированными двойными связямиПример: СН2 =
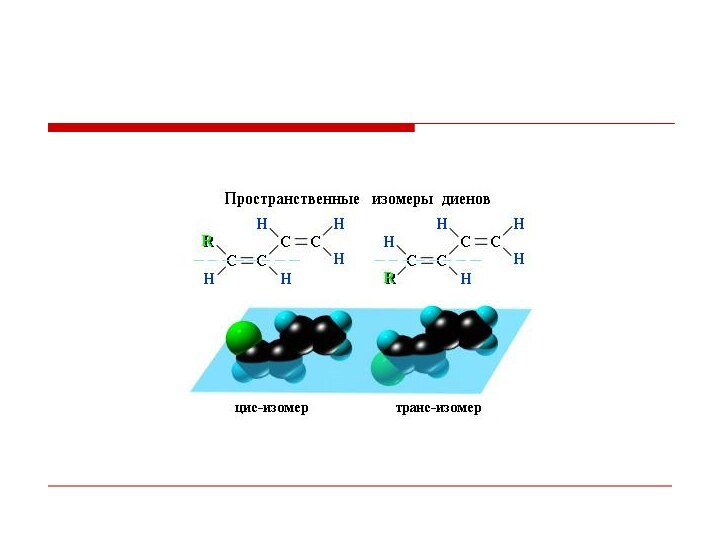
- 12. Характерный тип реакции для алкадиенов:Виды изомерии:
- 13. Характерный тип реакции для алкадиенов: электрофильное присоединение,
- 14. Скачать презентацию
- 15. Похожие презентации
Цель урока:опираясь на имеющиеся знания по углеводородам, изучить класс алкадиеныФорма организации познавательной деятельности: самостоятельная работа обучающихся













Слайд 3
Основные теоретические сведения
Название класса:
Классификация:
Характеристические признаки:
Общая формула:
Слайд 4
Основные теоретические сведения
Название класса: алкадиены, диеновые углеводороды
Классификация: ациклические
ненасыщенные углеводороды.
Характеристические признаки: открытая углеродная цепь, молекулы содержат две
двойные углерод-углеродные связи, все остальные углерод-углеродные связи одинарные.Общая формула: Сn H2n -2
Слайд 5
Алкадиены с кумулированными двойными связями
Пример:
Другие названия:
Особый характеристический признак:
Тип
гибридизации атома углерода:
Геометрия молекул:
Слайд 6
Алкадиены с кумулированными двойными связями
Пример: СН2 = С
= СН2
Другие названия: кумулированные диены, 1,2-диены. аллены
Особый характеристический признак:обе
двойные углерод-углеродные связи находятся при одном атоме углерода.Тип гибридизации: атом углерода, образующий две двойные связи находится в состоянии sp-гибридизации, атомы углерода, образующие по одной двойной связи, - в состоянии sp2-гибридизации
Геометрия молекул: три атома углерода находятся на одной линии, длина связи С = С 0,131
Слайд 7
Алкадиены с сопряжёнными двойными связями
Пример:
Другие названия:
Особый характеристический признак:
Тип
гибридизации атома углерода:
Геометрия молекул:
Слайд 8
Алкадиены с сопряжёнными двойными связями
Пример: СН3 – СН
= СН – СН = СН2
Другие названия: сопряжённые диены,
1, 3-диены.Особый характеристический признак: двойные углерод-углеродные связи находятся при соседних атомах углерода и чередуются с одинарной чсвязью.
Тип гибридизации: атом углерода, образующий двойные связи находится в состоянии sp2 -гибридизации, остальные - в состоянии sp3-гибридизации
Геометрия молекул: четыре атома углерода, образующие сопряжённую систему, находятся в одной плоскости;, длина связи С = С 0,137 нм, длина связи C – C 0,146 нм, длина связи C – H 0,109 нм,
Слайд 10
Алкадиены с изолированными двойными связями
Пример:
Другие названия:
Особый характеристический признак:
Тип
гибридизации атома углерода:
Геометрия молекул:
Слайд 11
Алкадиены с изолированными двойными связями
Пример: СН2 = СН
– СН2 – СН = СН2
Другие названия: диеноые углеводороды
с изолированными двойными связями, 1,4 –диены, 1,5-диены, и т.д.Особый характеристический признак: между атомами углерода, которые образуют двойные углерод-углеродные связи, находится хотя бы одинатом углерода, образующий только одинарные связи
Тип гибридизации: атомы углерода, образующий двойные связи, находится в состоянии sp2 -гибридизации, остальные - в состоянии sp3-гибридизации
Геометрия молекул: геометрия молекул не отличается от геометрии алкенов: длина связи С = С 0,132 нм, длина связи C – C 0,154 нм, длина связи C – H 0,107 нм,