Великие законы мирозданья в сущности,
наивны и просты.
И порой Вам не хватает знанья
для разгадки этой простоты.
Слайд 3
Прослушав легенду, попробуйте
отгадать о каком элементе
3-й группы идет речь?
Слайд 4
“Однажды к древнеримскому императору Тиберию правившему Римом в
14–27 гг. н. э., пришёл ремесленник и принёс чашу
невиданной красоты, изготовленную из серебристого и на удивление лёгкого металла. На вопрос императора о названии чудесного
металла ремесленник ответил, что
металл получен им из …глины и пока
не имеет названия. “Дальновидный”
император,испугавшись, что новый металл,
который можно получать из обыкновенной глины, обесценит серебро и подорвёт могущество Рима, повелел:
чашу уничтожить, ремесленника обезглавить, а его мастерскую сравнять с землёй!”
Слайд 5
Как вы думаете о каком металле идет речь?
Верно!
Речь сегодня пойдет,
ОБ АЛЮМИНИИ
Слайд 6
Тема урока:
«Алюминий и его свойства»
30.10.13г.
Слайд 7
В результате изучения темы вы будете способны:
Давать хар-ку
алюминия как
хим.элементу по ПСХЭ
Давать хар-ку
алюминию как простого в-ва по плану:
- получение
- физические свойства
- химические свойства
- применение алюминия
Быть толерантными! Анализировать и делать выводы! Отстаивать свою точку зрения! Уважать мнение других!
Слайд 8
I. Характеристика химического элемента:
1.Порядковый номер
2.Относительная атомная масса
3.Заряд ядра атома
4.Число протонов
5.Число электронов
6.Число нейтронов
Al
27
+13
0
№
= 13
Ar (Al) = 27
Z = +13
р+ = 13
ē = 13
n0 =27-13=14
Слайд 9
II.Нахождение в природе
По распространенности в земной коре алюминий занимает
3-е место после кислорода и кремния среди всех атомов и 1-е
место — среди металлов. Встречается только в составе соединений.
Слайд 10
ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
АЛЮМОСИЛИКАТЫ
КОРУНД Al2O3
– прозрачные кристаллы
Слайд 11
III. Получение алюминия:
Впервые алюминий был получен датским физиком
Гансом Эрстедом в 1825 году действием амальгамы калия на
хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы.
AlCl3 + 3K = 3KCl + Al
В настоящее время алюминий получают электролизом оксида:
эл.ток
2Al2O3 = 4Al + 3O2 – 3352 кДж
Слайд 13
IV. Физические свойства алюминия:
Агрегатное состояние
Цвет
Блеск
Плотность
Твердость
Пластичность
Прочность
Растворение в воде
Теплопроводность
Магнитные свойства
Электропроводность
Работа
с учебником: стр. 47-48
Слайд 14
IV. Физические свойства алюминия:
Алюминий
–
металл серебристо- белого цвета,
лёгкий ( q= 2,7
г/ см3),
ковкий,
пластичный,
электро- и теплопроводный, легко поддаётся обработке, образует лёгкие и прочные сплавы,
магнитных свойств нет.
Слайд 15
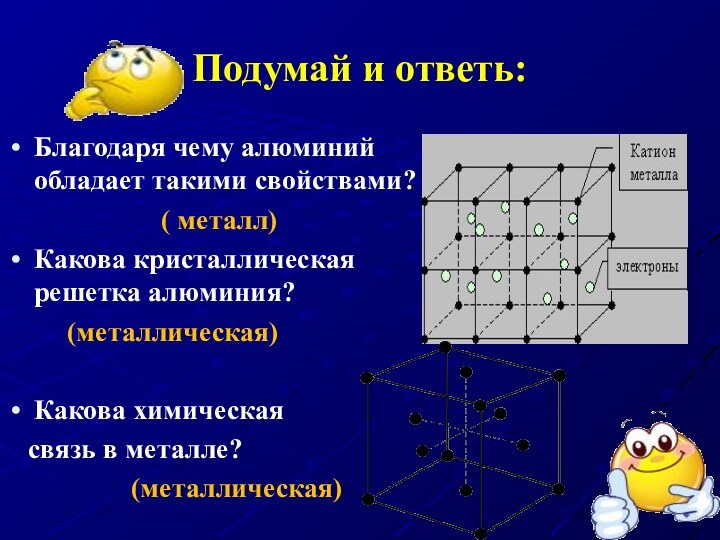
Подумай и ответь:
Благодаря чему алюминий обладает такими свойствами?
( металл)
Какова кристаллическая решетка алюминия?
(металлическая)
Какова химическая
связь в металле?
(металлическая)
Слайд 16
V. Химические свойства алюминия:
Алюминий –
активный металл?
Al ↔ Al
+3
0
3 ē
ок-ся
вос-ль
Al
27
13
2 ē
8 ē
3 ē
Слайд 17
Ребята, берегите зрение!
Ребята, берегите зрение!
Слайд 18
Генетический ряд алюминия:
Al → Al2O3 → Al(OH)3
AlCl3
NaAlO2
(видео) 4Al+3O2 = 2Al2O3
(видео) 2Al+3Br2 = 2Al Br3
2 Al+3I2 = 2Al I3
2Al+3S = Al2S3
t0
А.Взаимодействие с простыми веществами
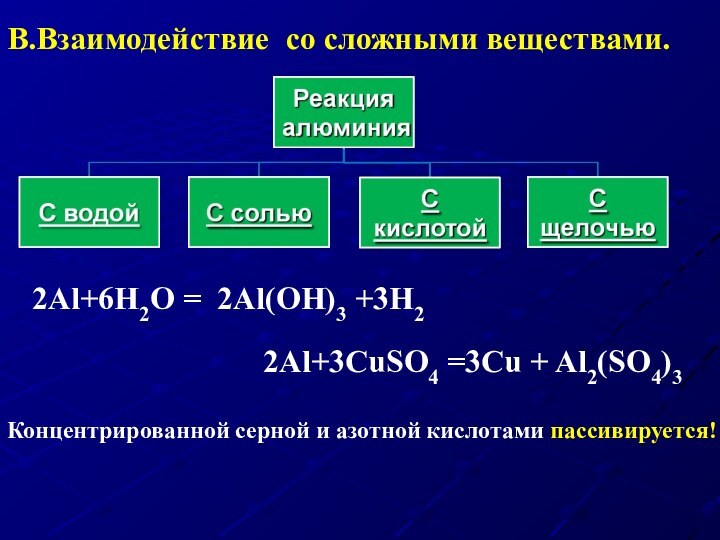
2Al+3CuSO4 =3Cu + Al2(SO4)3
2Al+6Н2O = 2Al(OH)3 +3H2
Концентрированной серной и азотной кислотами пассивируется!
В.Взаимодействие со сложными веществами.
Слайд 21
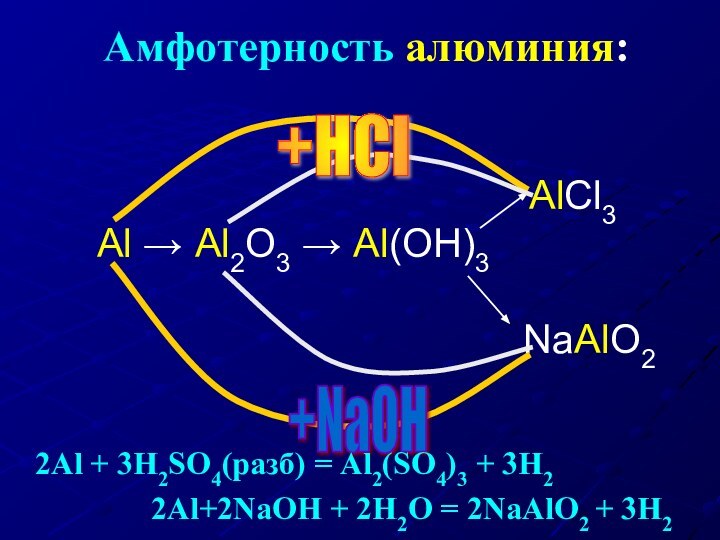
Амфотерность алюминия:
Al → Al2O3 → Al(OH)3
AlCl3
NaAlO2
+HCl
+NaOH
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
2Al+2NaOH + 2H2O = 2NaAlO2 + 3H2
Слайд 22
Активность алюминия
Вывод: Алюминий - активный металл, реагирует со
многими простыми и сложными веществами.
В реакциях является восстановителем
неметаллов и менее активных металлов.
Алюминий амфотерный металл –он реагирует и с кислотами и с основаниями.
Слайд 23
VI. Применение алюминия
для производства легких сплавов (дюралюмин, силумин)
в самолето– и автомобилестроении
для покрытия чугунных и стальных изделий
с целью повышения их коррозионной стойкости
для изготовления
контейнеров, фольги
в строительной
промышленности
Слайд 24
NB!Сплавы на основе алюминия
Алюминиево-магниевые
Алюминиево-марганцевые
Алюминиево-медные
Сплавы системы Al-Zn-Mg
Алюминиево-кремниевые сплавы (силумины)
Комплексные сплавы на основе алюминия: авиаль,
дюралюминий
Слайд 25
Алюминий в мировой культуре
Поэт Андрей Вознесенский написал в
1959 году стихотворение «Осень», в котором использовал алюминий в
качестве художественного образа:
…А за окошком в юном инее
лежат поля из алюминия…
Слайд 26
Алюминий в мировой культуре
Виктор Цой написал песню «Алюминиевые
огурцы» с припевом:
Я сажаю алюминиевые огурцы
На брезентовом поле
Я сажаю
алюминиевые огурцы
На брезентовом поле
Слайд 27
Токсичность Al
Отличается незначительным токсическим действием, но многие растворимые
в воде неорганические соединения алюминия сохраняются в растворённом состоянии
длительное время и могут оказывать вредное воздействие на человека и теплокровных животных через питьевую воду. Наиболее ядовиты хлориды, нитраты, ацетаты, сульфаты
Слайд 28
Экспресс- опрос
1.Сколько электронов на последней оболочке у атома
алюминия. А.1 В.4 C. 3
D. 6
2. С какими из указанных веществ реагирует алюминий?
А. СаО C. HCl
В. Cl2 D. Fe(OH)3
3. Какие из указанных металлов являются более активными, чем алюминий?
А. Na В. Ca C. Cu D. Fe
4. Наиболее характерная степень окисления алюминия:
А. +1 В. +3 C. +2 D. +4
5. Алюминий в химических реакциях проявляет свойства:
А. окислителя C. инертного соединения
В. восстановителя D. окислителя и восстановителя
Слайд 29
Подведем -итоги
Над какой темой мы сегодня работали?
Что нового
мы узнали об алюминии?
Решили ли мы проблему об активности
алюминия?
К каким выводам пришли?
Оцените свою работу на уроке!
Слайд 30
«Острова»
о. Грусти
О. Удовольствия
о.Тревоги
о.Просветления
о. Воодушевления
о.Неопределенности
о.
Недоумения
о.Радости
о.Бермудский
треугольник
Слайд 31
Домашнее задание
Разобрать и выучить конспект.
Выучить параграф: § 2.8
Выполнить
упр: 1,3,2* стр. 51.