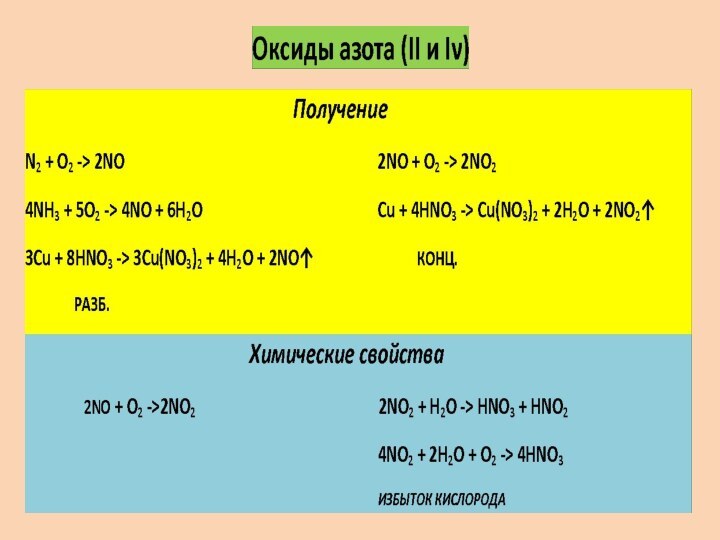
с резким характерным запахом (запах нашатырного спирта), почти вдвое
легче воздуха, ядовит.По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы.
Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах.
Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.