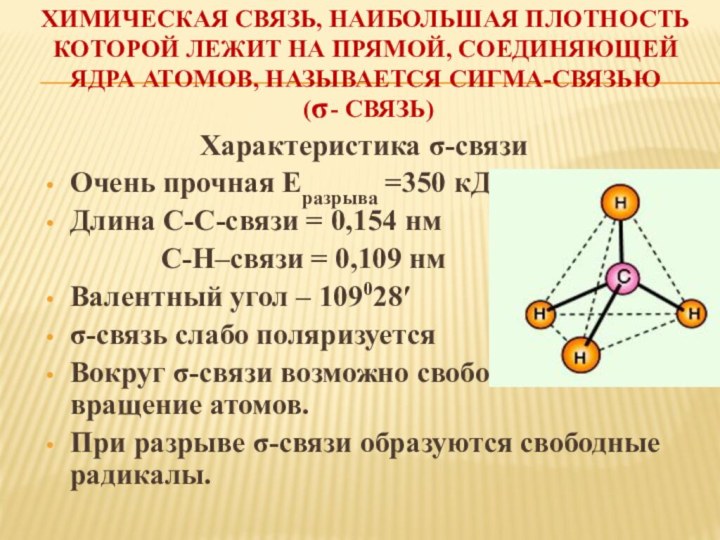
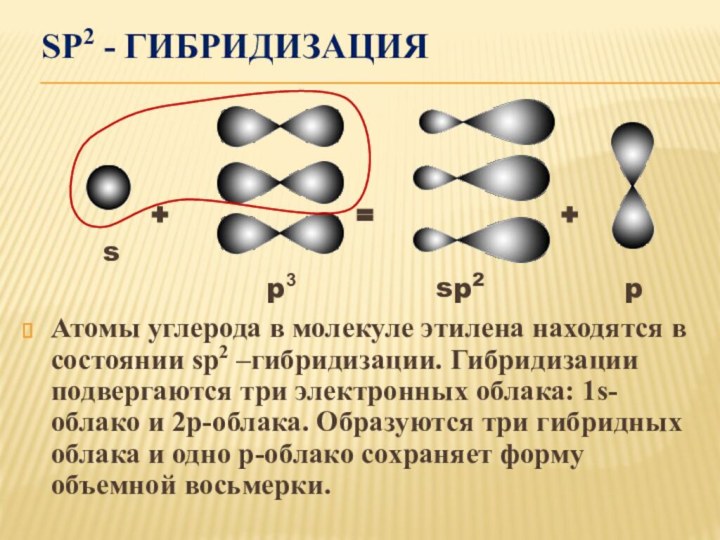
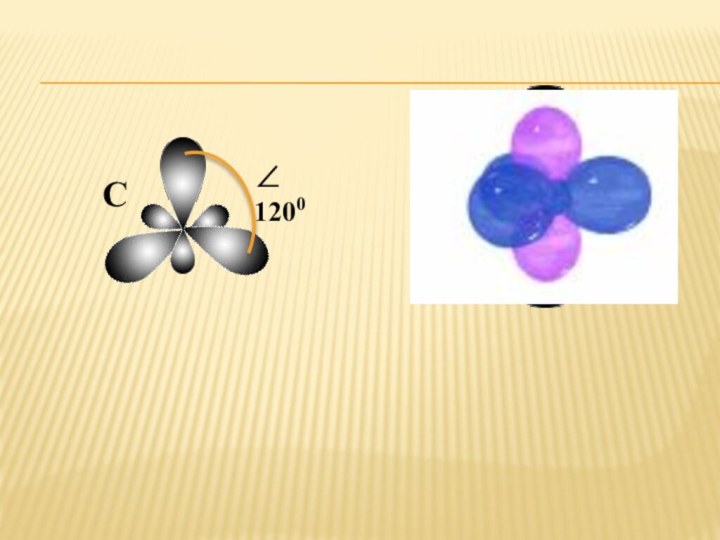
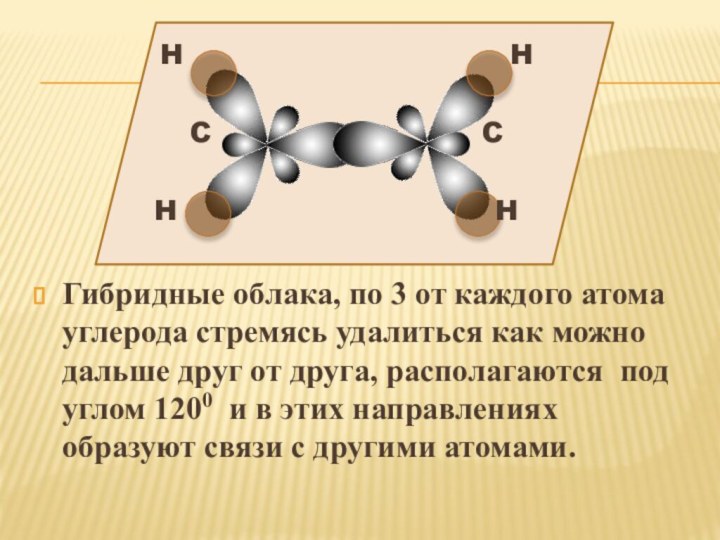
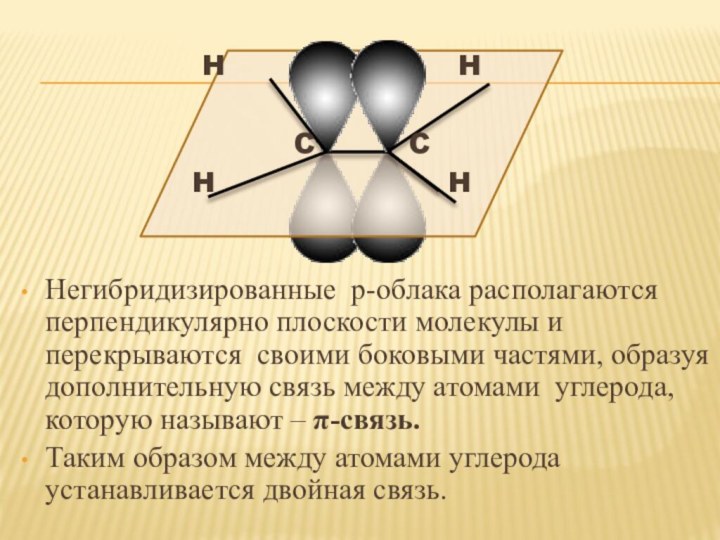
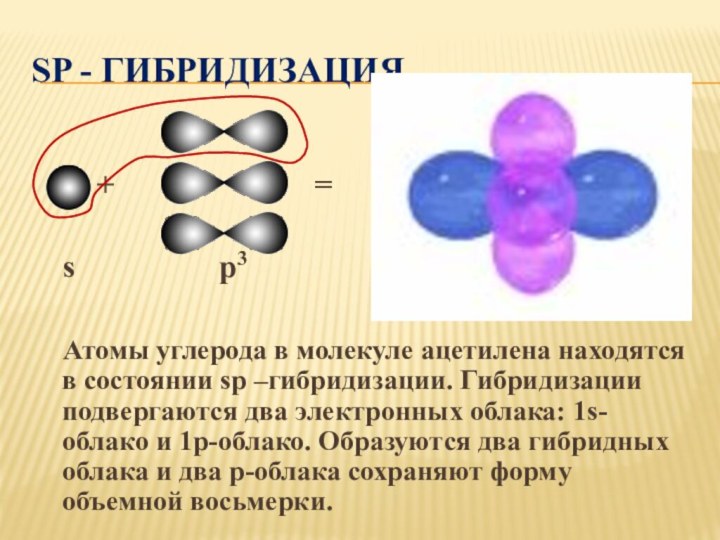
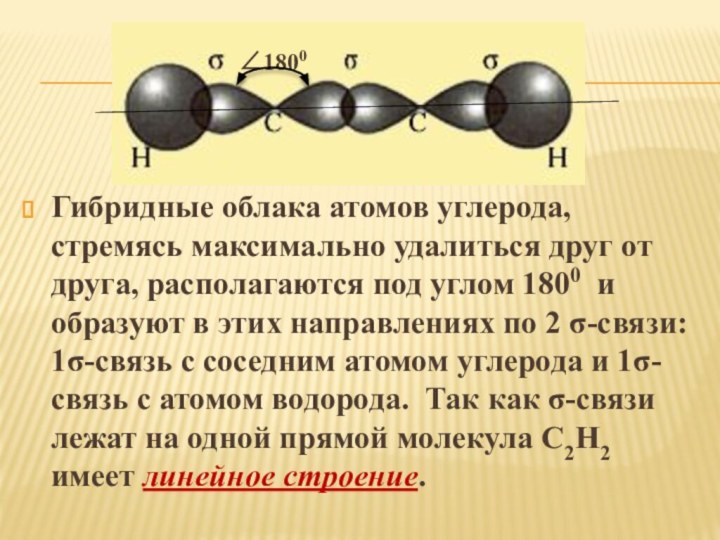
2s2 2p2
С -
На наружном энергетическом уровне 4 электрона: 2s-электрона спаренные и 2р-электро-на неспаренные.
Возбужденное состояние атома углерода
2s1 2p3
С -
Так как есть свободная р-орбиталь, то на нее переходит один из s-электронов. И все 4 электрона становятся неспаренными.
*