- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аминокислоты и белки химия 10 класс
Содержание
- 2. План характеристики: Определение класса Классификация Изомерия Свойства Получение Применение
- 3. Органические соединения, в молекулах которых содержатся карбоксильная
- 4. Аминокислоты – производные карбоновых кислот, которые можно
- 5. Аминокислоты – гетерофункциональные(бифункциональные) соединения, которые обязательно содержат
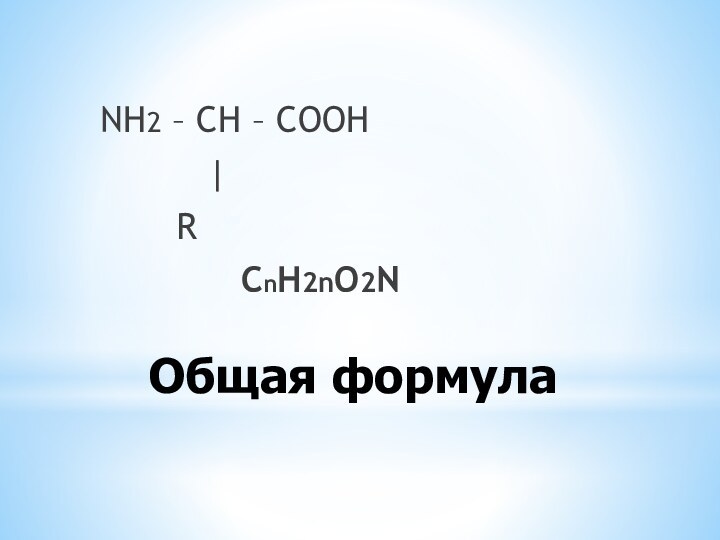
- 6. Общая формулаNH2 – CH – COOH | R СnH2nO2N
- 7. Классификация По взаимному расположению функциональных групп:
- 8. 5 4 3 2
- 9. По количеству функциональных групп :-моноаминомонокарбоновые -диаминомонокарбоновые
- 10. изомерияизомерия углеродного скелетаизомерия положения NH2оптическая изомерия:
- 12. Физические свойства:Б/ц кристаллические вещества, температура плавления > 2000, растворимы, сладкие, горькие, безвкусные (от состава радикала)
- 13. Химические свойства Аминокислоты – амфотерые соедиения1) Как
- 14. б) со спиртамиNH2-CH-COOH+С2Н5ОН → NH2-CH-COOС2Н5 +
- 15. 2) Как основанияа) с кислотамиNH2 – CH
- 16. 3) Растворимость в воде N+H3
- 17. 4) Специфическое - взаимодействие между собой (Реакция
- 18. O
- 19. Вывод: α-аминокислоты – элементарные частицы природных полимеров- белков Аминокислота1+ Аминокислота2=дипепидидАминокислота1+Аминокислота2+Аминокислота3=трипептид…
- 20. лабораторный уксусная кислота →хлоруксусная кислота→аминоуксусная кислотаСН3-СООН +
- 21. 1806г. Луи Воклен и Пьер РобикеСок спаржи
- 22. В живых организмах:Природные аминокислоты (около 150)Протеиногенные аминокислоты
- 23. 1909г. К. Икеда Сушеные водоросли – усиливают
- 24. Белки Жизнь –
- 25. Белки – это высокомолекулярные органические соединения,представляющиесобой биополимер, состоящий из мономе ров,которыми являются аминокислоты соединенные пептидной связью
- 27. Основными структурными компонентами белков являются аминокислоты.
- 28. Строение белков В начале
- 29. БЕЛКИ - это высокомолекулярные азотсодержащие органические вещества,
- 31. ■ Вторичная структура – форма
- 32. Третичная структура – реальная трехмерная конфигурация, которую
- 33. Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс. (Несколько цепей)
- 35. ФУНКЦИИ БЕЛКОВ ► Строительная –
- 36. Химические свойства белков 1. Гидролиз белков Гидролиз белков сводится к расщеплению полипептидных связей:
- 37. 2. Денатурация белков Денатурация
- 38. 3. Цветные качественные реакции белков
- 39. Превращения белков в организме
- 40. Значение белковОтдельные белки находят применение в народном
- 41. Скачать презентацию
- 42. Похожие презентации
План характеристики: Определение класса Классификация Изомерия Свойства Получение Применение






























Слайд 2
План характеристики:
Определение класса
Классификация
Изомерия
Свойства
Получение
Применение
Слайд 4 Аминокислоты – производные карбоновых кислот, которые можно рассматривать
как продукты замещения одного или более атомов водорода в
их радикалах на одну или более аминогруппСлайд 5 Аминокислоты – гетерофункциональные(бифункциональные) соединения, которые обязательно содержат две
функциональные группы: аминогруппу – NH2 и карбоксильную группу –COOH,
связанные с углеводородным радикалом
Слайд 7
Классификация
По взаимному расположению функциональных групп:
α
С – С- С – С
– СООН| β α
NH2 С – С- С – С – СООН
| NH2
γ β α
С – С- С – С – СООН
|
NH2
Слайд 8 5 4 3 2
1
С – С- С – С – СООН
| 5 4 3 2 1 NH2 С – С- С – С – СООН| NH2
5 4 3 2 1
С – С- С – С – СООН
|
NH2
Слайд 9
По количеству функциональных групп :
-моноаминомонокарбоновые
-диаминомонокарбоновые
С-С-С-С-С –СООН
׀
׀NH2 NH2
лизин
Слайд 11
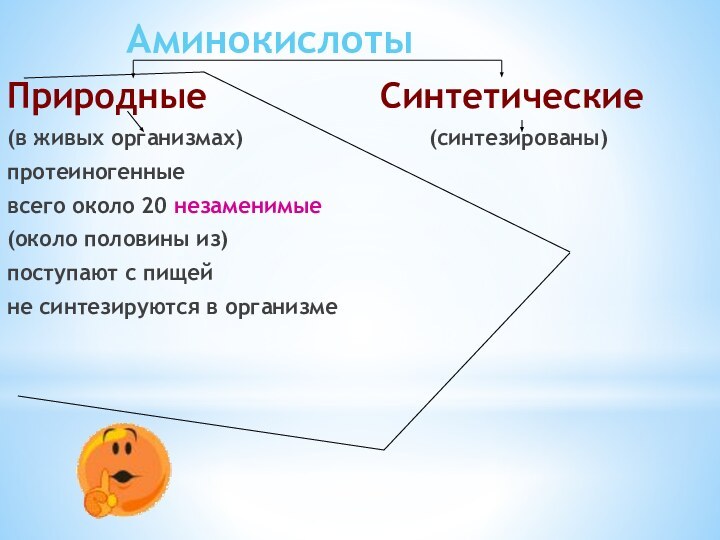
Аминокислоты
Природные
Синтетические(в живых организмах) (синтезированы)
протеиногенные
всего около 20 незаменимые
(около половины из)
поступают с пищей
не синтезируются в организме
Слайд 12
Физические свойства:
Б/ц кристаллические вещества, температура плавления > 2000,
растворимы, сладкие, горькие, безвкусные (от состава радикала)
Слайд 13
Химические свойства
Аминокислоты – амфотерые соедиения
1) Как кислоты
а) с
основаниями
NH2-CH-COOH + NaOH → NH2-CH-COONa + H2O
| | R R
натриевая соль
аминокислоты
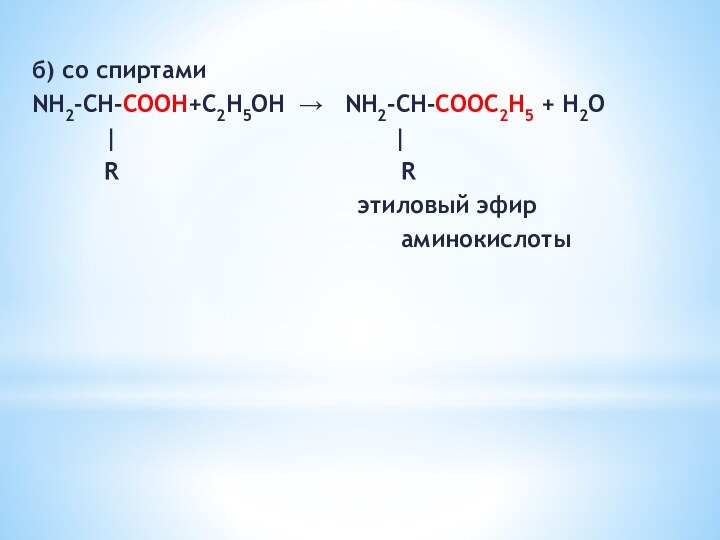
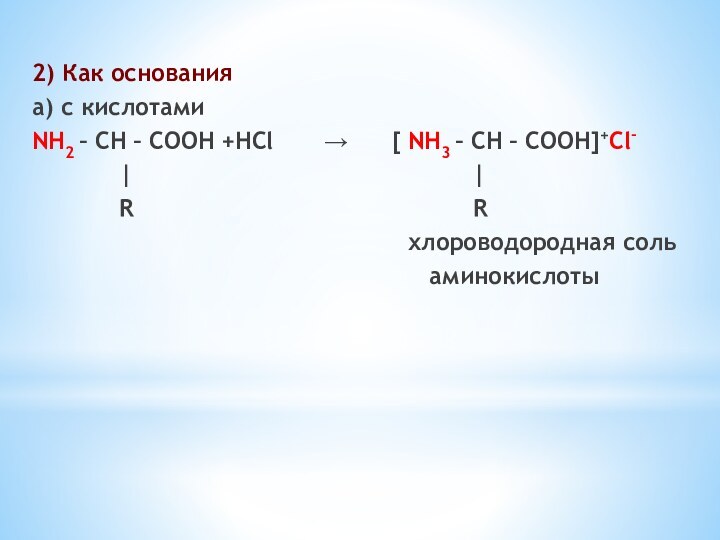
Слайд 15
2) Как основания
а) с кислотами
NH2 – CH –
COOH +HCl → [
NH3 – CH – COOH]+Сl-| |
R R
хлороводородная соль
аминокислоты
Слайд 17
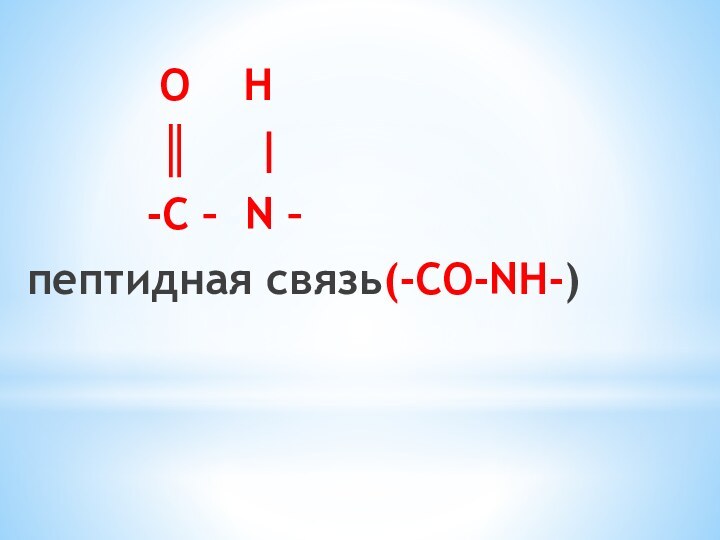
4) Специфическое - взаимодействие между собой
(Реакция поликонденсации)
NH2–CH2–COOH +
NH2–CH2–COOH
→ NH2–CH2–CO-NH–CH2–COOH+Н2О
пептидная связьполипептид
Слайд 19
Вывод:
α-аминокислоты – элементарные частицы природных полимеров- белков
Аминокислота1+ Аминокислота2=дипепидид
Аминокислота1+Аминокислота2+Аминокислота3=трипептид…
Слайд 20
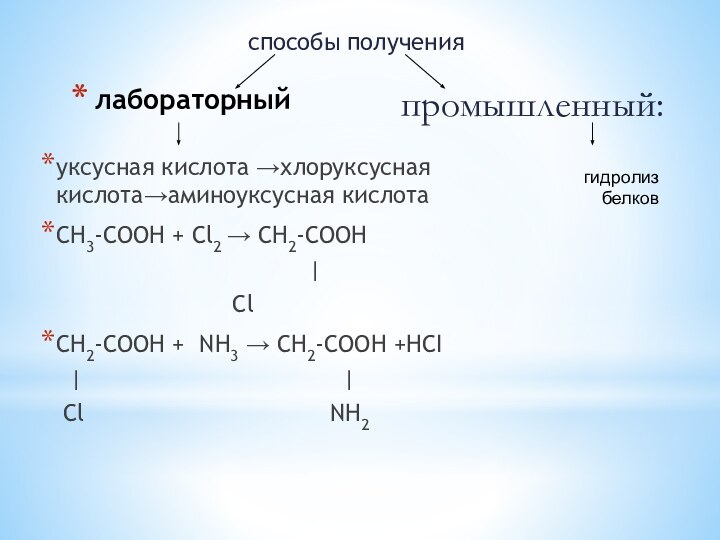
лабораторный
уксусная кислота →хлоруксусная кислота→аминоуксусная кислота
СН3-СООН + Сl2
→ СН2-СООН
| Cl
СН2-СООН + NH3 → СН2-СООН +HCI
| |
Сl NH2
способы получения
гидролиз белков
промышленный:
Слайд 21
1806г. Луи Воклен и Пьер Робике
Сок спаржи
выделили белое кристаллическое вещество – аспарагин (первая
аминокислота, выделенная химиками из природных объектов)1848г. Рафаэль Пириа
Гидролиз аспарагина аспарагиновая кислота
НО-С-СН2-СН-СООН
║ |
О NH2
Слайд 22
В живых организмах:
Природные аминокислоты (около 150)
Протеиногенные аминокислоты (около
20) в белках
Незаменимые:
валин, лейцин, лизин, треонин, цистеин и
др.Антибиотики (пенициллин)
Полиамидные смолы (капрон, нейлон)
*Добавка к корму
Слайд 23
1909г. К. Икеда
Сушеные водоросли – усиливают аромат
и вкус пищи – пищевые добавки.
Е 621, Е 620,
Е 622-625Назвать кислоту, записать уравнения реакций взаимодействия данной аминокислоты с кислотой, основанием, спиртом
СН3 – СН - СООН
|
NH2
NH2 – С2Н4 - СООН
(аланин)
Слайд 24
Белки
Жизнь – это
форма существования белковых тел
Белок – это
мышцы, соединительные ткани (сухожилия, связки, хрящи).Белковые молекулы включены в состав костной ткани.
Из особых форм белка сотканы волосы, ногти, зубы, кожный покров.
Из белковых молекул образуются отдельные очень важные гормоны, от которых зависит здоровье.
Большинство ферментов также включают белковые фрагменты, а от ферментов зависит качество и интенсивность происходящих в организме физиологических и биохимических процессов.
Содержание белков в различных тканях человека неодинаково. Так, мышцы содержат до 80% белка, селезенка, кровь, легкие – 72%, кожа – 63%, печень – 57%, мозг – 15%, жировая ткань, костная и ткань зубов – 14–28%.
Слайд 25
Белки – это высокомолекулярные органические соединения,представляющиесобой биополимер, состоящий из мономе ров,которыми являются аминокислоты соединенные пептидной связью
Слайд 26
В состав белков входят:
Гемоглобин - С3032H4816O872N780S8Fe4
Mr белка яйца = 36 000,
Mr белка мышц = 1 500 000.
железо
другие элементы
фосфор
сера
азот
кислород
водород
углерод
Слайд 28
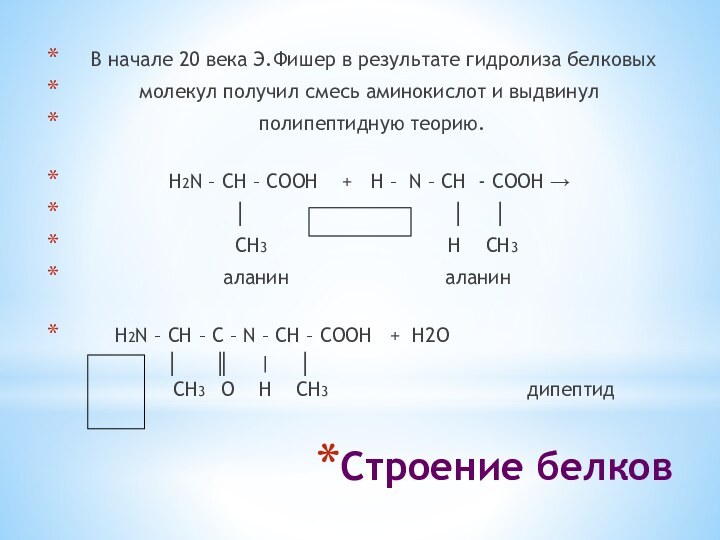
Строение белков
В начале 20 века
Э.Фишер в результате гидролиза белковых
молекул получил смесь аминокислот и выдвинул полипептидную теорию.
H2N – CH – COОН + Н – N – CH - COOH →
│ │ │
CH3 H CH3
аланин аланин
H2N – CH – C – N – CH – COOH + Н2О
│ ║ | │
CH3 О Н CH3 дипептид
Слайд 29 БЕЛКИ - это высокомолекулярные азотсодержащие органические вещества, структурным
компонентом которых являются α-аминокислоты, связанные пептидными связями.
В состав белков
входит 20 различных аминокислот.Кроме понятия «белок», в химии встречается термины «ПЕПТИД» и «ПОЛИПЕПТИД».
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Слайд 30
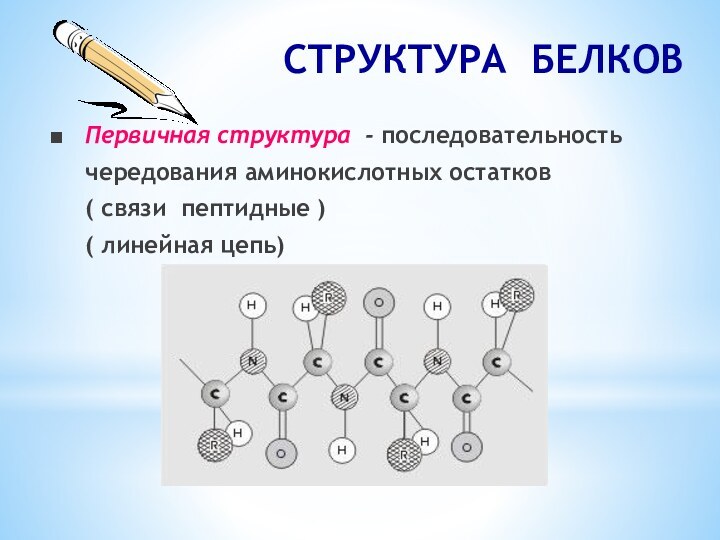
СТРУКТУРА БЕЛКОВ
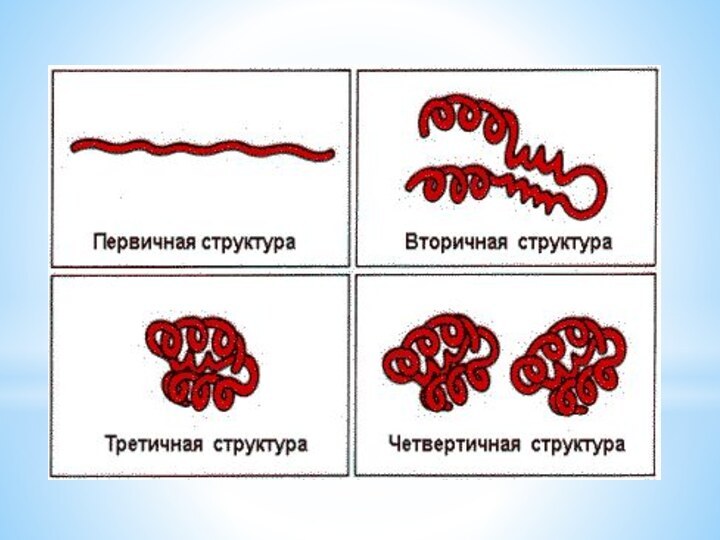
■ Первичная структура - последовательность
чередования аминокислотных остатков( связи пептидные )
( линейная цепь)
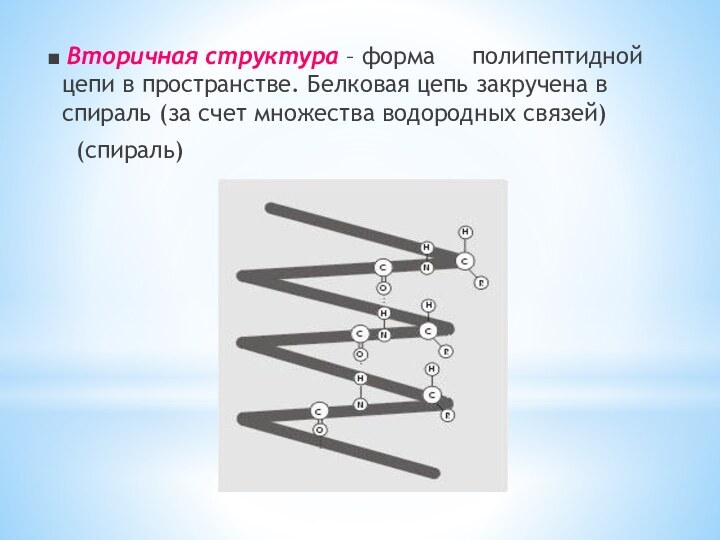
Слайд 31 ■ Вторичная структура – форма полипептидной
цепи в пространстве. Белковая цепь закручена в спираль
(за счет множества водородных связей)(спираль)
Слайд 32 Третичная структура – реальная трехмерная конфигурация, которую принимает
в пространстве закрученная спираль (за счет гидрофобных связей), у
некоторых белков – S–S-связи (бисульфидные связи)(клубок)
Слайд 33 Четвертичная структура – соединенные друг с другом макромолекулы
белков образуют комплекс.
(Несколько цепей)
Слайд 35
ФУНКЦИИ БЕЛКОВ
► Строительная – белки
участвуют в образовании оболочки клетки, органоидов и мембран клетки.
Из белков построены кровеносные сосуды, сухожилия, волосы► Каталитическая – все клеточные катализаторы –
белки (активные центры фермента).
► Двигательная – сократительные белки вызывают
всякое движение.
► Транспортная – белок крови гемоглобин присоединяет кислород и разносит его по всем тканям.
► Защитная – выработка белковых тел и антител для обезвреживания чужеродных веществ.
► Энергетическая – 1 г белка эквивалентен 17,6 кДж.
► Рецепторная – реакция на внешний раздражитель.
Слайд 36
Химические свойства белков
1. Гидролиз белков
Гидролиз белков сводится к расщеплению полипептидных связей:
Слайд 37
2. Денатурация белков
Денатурация –
нарушение природной структуры белка под действием нагревания и химических
реагентов.а) высокая или низкая температура
б) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов (Pb, Hg и др.)
Слайд 38
3. Цветные качественные реакции белков
а) Биуретовая реакция (Cu(OH)2);
б) ксантопротеиновая реакция (HNO3
конц.);в) взаимодействие белка с ацетатом свинца
при нагревании.
г) горение белка
Слайд 40
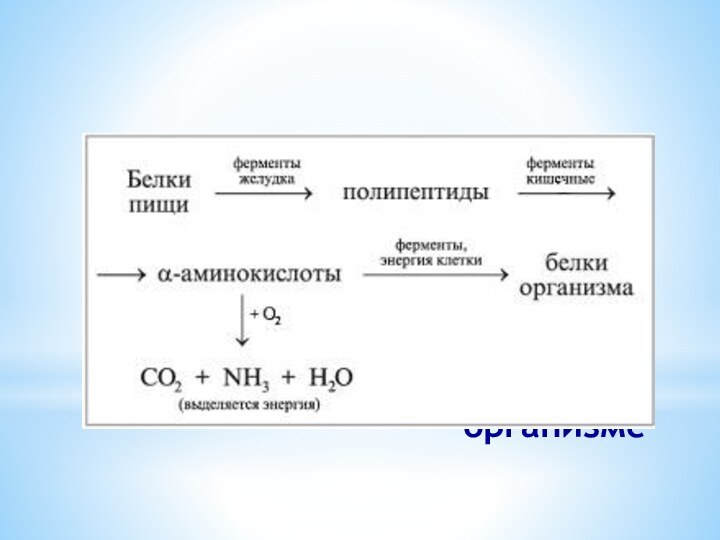
Значение белков
Отдельные белки находят применение в народном хозяйстве,
например белки шерсти, шелка, кожи и рогов животных.
Выяснение структуры
белков, их многообразных функций в организме позволяет понять механизм наследственности, что в свою очередь, имеет большое значение для выведения высокопродуктивных пород животных и сортов растений.Изучение белков важно и для выяснения природы заболеваний, наблюдаемых у человека и животных





























